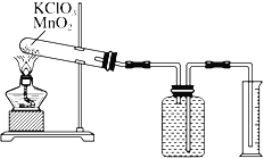
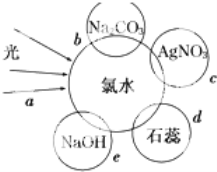
-
下列说法中不正确的是
A. Na2O2可用作呼吸面具中氧气的来源
B. Na2O和Na2O2投入水中都能生成NaOH
C. Na2O2和Na2O均可以露置在空气中保存
D. NaCl的性质稳定,可用作调味品
难度: 中等查看答案及解析
-
300 ml 0.1 mol/L的ALCl3溶液与200 ml 0.3 mol/L的NaCl溶液中c(Cl-)之比为
A. 1:1 B. 1:2 C. 1:3 D. 3:2
难度: 中等查看答案及解析
-
标准状况下有①0.112 L 水;②3.01×1023 个氯化氢分子;③13.6 g H2S 气体;④0.2 mol NH3,下列对这 四种物质的关系由小到大排列正确的是
A. 体积:①③②④ B. 密度:④①③②
C. 质量:①④③② D. 氢原子数:②④③①
难度: 中等查看答案及解析
-
A. 少量的钠保存在煤油中 B. 新制的氯水保存在棕色试剂瓶中
C. 漂白粉要密闭保存 D. 浓盐酸保存在敞口试剂瓶中即可
难度: 中等查看答案及解析
-
下列说法中,不正确的是
A. 研究物质的性质时,常用到观察、实验、分类、比较等方法
B. 制陶、冶金、酿酒等生产过程中,肯定发生了化学反应
C. 1869年俄国化学家门捷列夫提出了原子学说,为近代化学的发展奠定了基础
D. 我国化学家在1965年第一次人工合成了具有生命活性的蛋白质,为世界生命科学的研究和发展做出了贡献
难度: 中等查看答案及解析
-
已知NA为阿伏伽德罗常数,下列说法正确的是
A.2.3g金属钠变成钠离子时,失去的电子数为0.2NA
B.常温常压下,11.2L氯气中所含的原子数目为NA
C.通常状况下,32g氧气所含有的原子数目为2NA
D.100ml 2mol·L-1的氯化钠溶液中含各离子数目之和为0.2NA
难度: 中等查看答案及解析
-
下列有关实验现象的叙述中,不正确的是
A. 氢气在Cl2中燃烧,产生苍白色火焰,瓶口有白雾生成
B. 铁丝在Cl2中燃烧,产生棕红色的烟
C. 钠在Cl2中燃烧,生成白色的雾
D. 铜丝在Cl2中燃烧,生成棕黄色的烟
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值, 下列有关叙述正确的是
A. 1 mol OH-所含电子数为10NA
B. 2 L 0.5 mol·L-1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 LH2O 含有的氢原子数为0.1NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
难度: 中等查看答案及解析
-
下列叙述中正确的是
①标准状况下,1L HCl和1L H2O的物质的量相同;②标准状况下,1g H2和14g N2的体积相同;③28gCO的体积为22.4L;④两种物质的物质的量相同,则它们在标准状况下的体积也相同;⑤在同温同体积时,气体物质的物质的量越大,则压强越大;⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ①②③ B. ②⑤⑥ C. ②③⑥ D. ④⑤⑥
难度: 中等查看答案及解析
-
将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L的盐酸中,同温同压下产生的气体体积比是
A. 1∶2∶3 B. 3∶1∶1 C. 6∶3∶2 D. 1∶1∶1
难度: 中等查看答案及解析
-
使用胆矾(CuSO4·5H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是
A. 称取胆矾25g,溶解在1L水里
B. 将胆矾加热除去结晶水后,称取16g溶解在1L水里
C. 将16g胆矾溶于水,然后将此溶液稀释至1L
D. 将25g胆矾溶于水,然后将此溶液稀释至1L
难度: 中等查看答案及解析
-
下图分别表示四种操作,其中有两处错误的是
A. 读数
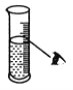 B. 稀释
B. 稀释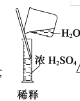
C. 称量
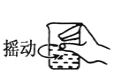 D. 溶解
D. 溶解
难度: 中等查看答案及解析
-
将钠和碳分别置于如图所示的两个盛满足量氧气的集气瓶中燃烧完毕后,同时打开装置中的两个止水夹,这时观察到
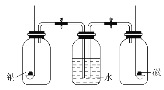
A. 水进入左瓶 B. 水进入右瓶
C. 水同时进入两瓶 D. 水不进入任何一瓶
难度: 简单查看答案及解析
-
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)(单位: mol·L-1)为
A. (y-2x)/a B. (y-x)/a C. (2y-2x)/a D. (2y-4x)/a
难度: 中等查看答案及解析
-
将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是
A. 稀盐酸 B. K2SO4 C. CuCl2 D. NaOH 溶液
难度: 中等查看答案及解析