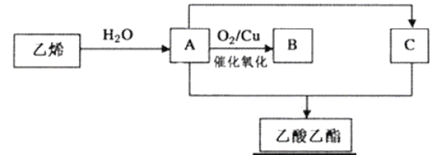
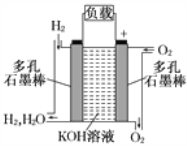
-
下列说法正确的是
A. 乙烷的一氯代物同分异构体有1种,二氯代物的同分异构体有3 种
B. 正戊烷的一氯代物同分异构体有3 种,二氯代物的同分异构体有9 种
C. 正丁烷的一氯代物同分异构体有2 种,二氯代物的同分异构体有5 种
D. 丙烷的一氯代物同分异构体有2 种,二氯代物的同分异构体有5 种
难度: 困难查看答案及解析
-
CH2=CH2与 H2反应的能量与反应进程关系如图所示.下列说法错误的是( )

A. 该反应为放热反应
B. 催化剂Ⅱ比催化剂Ⅰ活性更好
C. 催化剂可改变反应的活化能和焓变
D. 正反应的活化能小于逆反应的活化能
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = -57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1
D. 1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g) △ H=-285.8 kJ· mol-1
难度: 中等查看答案及解析
-
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
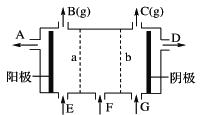
A. b是阳离子交换膜,允许Na+通过
B. 从A口出来的是NaOH溶液
C. 阴极反应式为4OH--4e-= 2H2O+O2↑
D. Na2SO4溶液从G口加入
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )。
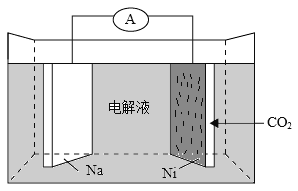
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e-=2CO32-+C
D. 充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池,该固体氧化物电解质在700-900℃温度时,O2-可在该固体氧化物电解质中自由移动,电池反应生成均为无毒无害的物质,下列说法正确的是( )

A. 电池内的O2-由电极乙移向电极甲
B. 电池的总反应为:N2H4+2O2=2NO+2H2O
C. 当甲电极上有1mol N2H4消耗时,乙电极上有1molO2被氧化
D. 电池外电路的电子由电极乙移向电极甲
难度: 困难查看答案及解析
-
下列事实不能用电化学原理解释的是 ( )
A. 铝片不需要特殊的保护方法 B. 炒过菜的铁锅未清洗易生锈
C. 轮船水线以下的船壳上镶有一定数量的锌 D. 镀锌铁比镀锡铁耐腐蚀
难度: 简单查看答案及解析
-
在某温度下,在一个2L的密闭容器中加入4molA和2molB进行如下反应:3A(g)+2B(g)⇌4C(s)+D(g),反应2min后达到平衡,测得生成1.6molC,下列说法正确的是()
A. 前2min,D的平均反应速率为0.2mol·L-1·min-1
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡不移动,化学平衡常数不变
D. 增加B的物质的量,平衡向右移动,B的平衡转化率增大
难度: 中等查看答案及解析
-
对于反应2SO 2+O 2⇌2SO 3,判断下列说法正确的是( )
①单位时间内生成2 mol SO2,同时生成1 mol O2,则处于化学平衡状态 ②SO2生成速率等于SO2消耗速率,则处于化学平衡状态 ③SO2、O2、SO3的体积分数不再发生变化,则处于化学平衡状态 ④SO2、O2、SO3的分子数之比为2∶1∶2,则处于化学平衡状态
A. ①③ B. ②④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
将1 mol X、3 mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+3Y(g) ⇌ 2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是
A. 升高温度,X的体积分数减小
B. 缩小体积,Y的物质的量浓度不变
C. 保持容器体积不变,充入一定量的稀有气体,Z的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
难度: 中等查看答案及解析
-
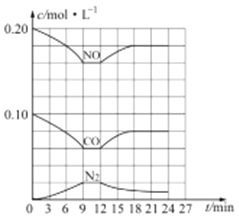
T℃时,在 2 L 的密闭容器中,气体 X、Y 和 Z 三种物质的物质的量随时间变化的曲线如图所示,下列描述正确的是
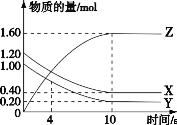
A. 容器中化学反应为 X(g)+Y(g)
Z(g)
B. 0~10 s,X 表示的平均化学反应速率为 0.04 mol/(L·s)
C. 使用催化剂只能加快 0~10 s 间的反应速率
D. 0~4 s 的平均反应速率小于 0~10 s 的平均反应速率
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的电子层数和最外层电子数相同,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A. 简单离子的半径大小:Y>W
B. 元素W的最高价氧化物对应的水化物的酸性比Z的弱
C. 单质Y和Z均能与强碱溶液反应生成氢气
D. W的气态氢化物稳定性强于X的气态氢化物
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 甲烷在光照条件下与 Cl2 发生取代反应生成的产物最多 4 种
B. 苯不能使酸性 KMnO4溶液褪色,可说明苯分子中不存在碳碳双键
C. 石油的分馏、煤的液化与气化都是物理变化
D. 乙烯中的碳碳双键的键长比乙烷中碳碳单键的键长长
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 金刚石和石墨互为同位素
B. C2H6和C5H12 互为同系物
C. C2H4和C2H6互为同系物
D. CH3CH2CH2CH3和CH3CH(CH3)2 互为同系物
难度: 中等查看答案及解析
-
已知某化学反应A 2(g) +2B 2(g) = 2AB 2(g)的能量变化如图所示,下列有关叙述中正确的是

A. 该反应是熵增加的反应
B. 该反应的ΔH=-(E1-E2) kJ·mol-1
C. 该反应的活化能为E2
D. 该反应中,反应物分子的键能总和大于生成物分子的键能总和
难度: 简单查看答案及解析