-
设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A. 10g46%乙醇水溶液中所含氢原子数目为0.6NA
B. 0.1mol·L-1AlCl3溶液中含有Cl-数目为0.3NA
C. 标准状况下,4.48L乙烯和环丁烷混合气中含碳原子数为0.4NA
D. 7.8gNa2O2与足量CO2 或H2O反应转移电子数为0.1NA
难度: 中等查看答案及解析
-
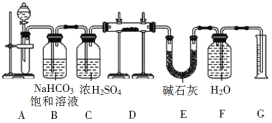
进行下列实验,相关说法正确的是( )
A. 图甲:蒸干CuSO4饱和溶液,制备CuSO4·5H2O晶体
B. 图乙:可形成红色喷泉,证明HC1极易溶于水
C. 图丙:配一定物质的量浓度NaOH溶液,若定容时视线如图,则所配NaOH溶液浓度偏低
D. 图丁:除去碳酸氢钠固体中的少量碳酸钠
难度: 中等查看答案及解析
-
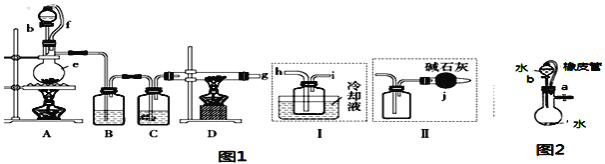
某兴趣小组用下图所示装置制备气体(酒精灯可以根据需要选择),对应说法正确的是

选项
①中药品
②中药品
③中药品
④中药品
制备气体
⑥中药品及作用
A
浓盐酸
MnO2
饱和食盐水
浓硫酸
C12
NaOH溶液,尾气吸收
B
稀硝酸
Cu
烧碱溶液
浓硫酸
NO
Na()H溶液,尾气吸收
C
浓盐酸
大理石
饱和Na2CO3溶液
浓硫酸
CO2
澄清石灰水,检验CO2
D
浓盐酸
Zn
水
浓硫酸
H2
可撤去
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
“银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为Ag+H2S+O2 → Ag2S+H2O(未配平)。当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。以下说法不正确的是( )
A. 当银针变黑时,所检验的物质有毒
B. 银针验毒时,Ag被氧化
C. 上述验毒反应的氧化产物和还原产物的物质的量之比为1∶1
D. 银针复原发生的反应可能为3Ag2S+2Al===6Ag+Al2S3
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是( )
A. 测0.1mol/L氨水的pH为11:NH3·H2O
NH4++OH-
B. 将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
D. Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
难度: 中等查看答案及解析
-
新型陶瓷AlN可通过反应: Al2O3+N2+3C
2AlN+3CO合成。下列正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.AlN中氮元素的化合价为+3
C.上述反应中,每生成1 mol AlN需转移3 mol电子
D.AlN的摩尔质量为41 g
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. 将H2O2滴加到酸性KMnO4溶液中:2MnO4-+ H2O2 + 6H+ === 2Mn2+ + 3O2↑+ 4H2O
B. 在NH4HSO4溶液中慢慢滴入等物质的量的NaOH溶液:NH4++ OH- === NH3·H2O
C. 用惰性电极电解氯化钠溶液:2H+ + 2Cl- === H2↑ + Cl2↑
D. 用酸性高锰酸钾溶液滴定草酸:2MnO4-+ 5H2C2O4 + 6H+ === 2Mn2+ + 10CO2↑ + 8H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 含大量Fe3+的溶液中:Na+、Mg2+、SO42—、SCN—
B.
=106的溶液中:NH4+、K+、AlO2—、NO3—
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42—、Cl—
D. 1.0 mol·L—1的KNO3溶液中:Fe2+、H+、Cl—、I—
难度: 中等查看答案及解析
-
某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
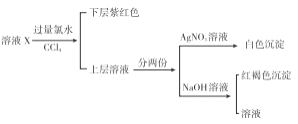
A. 溶液X中有Fe3+、SO42﹣
B. 溶液X中有Fe2+、I﹣可能有SO42﹣、Cl﹣
C. 溶液X中有I﹣、Cl﹣,无CO32﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
难度: 困难查看答案及解析
-
下列各组物项相互混合进行反应,既有气体生成最终又有沉淀生成的是( )
① 金属钠投入FeCl2溶液中
② 过量的NaOH溶液和明矾溶液反应
③ 少量CaO投入过量的NaHCO3溶液中
④Na2O2投入到CuSO4溶液中
A. ①③ B. ③④ C. ①④ D. ②③
难度: 简单查看答案及解析
-
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是
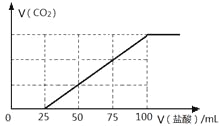
A. 原NaOH溶液的浓度为0.1 mol/L
B. 通入CO2的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3) =" 1:" 3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3) =" 2:" 1
难度: 困难查看答案及解析
-
在KOH和KAlO2混合溶液中滴加稀盐酸直到过量,生成沉淀与所加盐酸体积关系的图象正确的是( )
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是

A. ①、②中除加试剂外,还需要进行过滤操作 B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气 D. ④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析