-
某温度下,反应2N2O5
4NO2+O2开始时c(N2O5)=0.0408mol·L-1,经1 min后测得c(N2O5)=0.030mol·L-1,则该反应的反应速率为
A. v(N2O5)=1.08×10-4 mol•L-1•s-1 B. v(N2O5)= 1.8×10-1 mol•L-1•min
C. v(O2)=9.0×10-5 mol•L-1•s-1 D. 2 v(NO2)= v(N2O5)
难度: 中等查看答案及解析
-
下列关于有效碰撞理论与影响速率因素之间关系正确的是
A. 增大反应物浓度,可以提高活化分子百分数,从而提高反应速率
B. 通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率
C. 升高温度,可以提高活化分子的能量,会减慢反应速率
D. 加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率
难度: 简单查看答案及解析
-
对可逆反应:A(g)+3B(g)⇌2C(g) ΔH <0,下列叙述错误的是
A. 升高温度v(正)、v(逆)都增大,但v(正)增得更大
B. 增大压强v(正)、v(逆)都增大,但v(正)增得更大
C. 增大A的浓度v(正)会先增大后减小
D. 采用催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g) ②2HI(g)
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol/L,c(HI)=4 mol/L,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
难度: 中等查看答案及解析
-
在一定温度下的定容容器中,当反应A(s)+2B(g)
C(g)+D(g)达到平衡状态后,下列哪些物理量不再发生变化,
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①②③④⑤⑥
难度: 简单查看答案及解析
-
已知可逆反应aA+bB
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
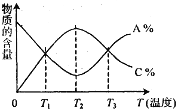
A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
难度: 中等查看答案及解析
-
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
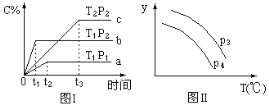
A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
难度: 中等查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )

A. 反应Ⅰ:ΔH>0,p2>p1
B. 反应Ⅱ:ΔH<0, T2>T1
C. 反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1
D. 反应Ⅳ:ΔH<0,T2>T1
难度: 困难查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为CO+H2O
CO2+H2
难度: 困难查看答案及解析
-
在体积恒定的密闭容器中,一定量的SO2与1.100molO2在催化剂作用下加热到600℃发生反应:2SO2+ O2
2SO3,ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,SO2的转化率为90%
难度: 中等查看答案及解析
-
在1L密闭容器中充入2molSO2和1molO2进行2SO2 + O2
2SO3 ΔH <0,达到平衡时SO2转化率为a%,在1L绝热容器中投料相同的情况下进行该反应,达到平衡时SO2转化率为b%,则下列关系正确的是
A. a%﹥b% B. a%﹤b% C. a%=b% D. a% 和b%的关系不确定
难度: 中等查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g) 、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图示:
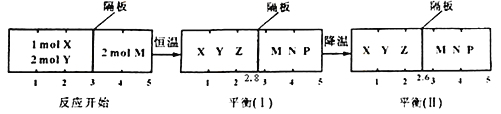
下列判断正确的是
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为
D. 在平衡(I)和平衡(II)中M的体积分数相等
难度: 困难查看答案及解析