-
在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( )
A.合金
B.半导体
C.催化剂
D.农药难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A.乙烯的最简式:CH2=CH2
B.CH4分子的比例模型:
C.羟基: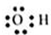
D.Cl-的结构示意图: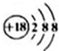
难度: 中等查看答案及解析
-
下列各组中,性质比较不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S难度: 中等查看答案及解析
-
下列各组物质中:①H2O、D2O和T2O②NO2和N2O4 ③冰与水 ④CH3CH3 和CH3CH2CCH3⑤NH4CNO和CO(NH2)2 ⑥CH3-CH2-OH和CH3-O-CH3 属于同分异构体的组合是( )
A.①③
B.②③
C.④⑤
D.⑤⑥难度: 中等查看答案及解析
-
某粒子用符号zAMn+表示,下列关于该粒子的叙述中,正确的是( )
A.所含质子数为(A-n)
B.所含中子数为(A-Z-n)
C.所含电子数为(Z+n)
D.中子数-电子数=A-2Z+n难度: 中等查看答案及解析
-
下列物质属于离子化合物且只含有离子键的是( )
A.HCl
B.CaCl2
C.NH4Cl
D.NH3难度: 中等查看答案及解析
-
关于元素周期律和元素周期表的下列说法,正确的是( )
A.元素性质呈周期性变化的决定因素是核外电子排布呈周期性变化
B.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化难度: 中等查看答案及解析
-
主族元素R的原子其电子式可用下式表示:
.该元素组成的以下物质,其分子式肯定错误的是( )
A.含氧酸分子式可能为H3RO4
B.含氧酸分子式可能为HRO3
C.气态氢化物分子式为RH5
D.最高价氧化物分子式为R2O5难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D,原子序数依次增大.A.C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
A.原子半径:A<B<C<D
B.非金属性:A>C
C.最高价氧化物对应水化物的酸性:D<C
D.单质B常温下能溶于浓硝酸难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.在共价化合物中不可能含有离子键
B.含有共价键的化合物不一定是共价化合物
C.主族元素形成的阴离子不一定都满足8电子结构
D.非金属之间形成的化学键一定是共价键难度: 中等查看答案及解析
-
制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:
①Si(粗)+3HCl(g)SiHCl3(g)+H2、②SiHCl3(g)+H2
Si(纯)+3HCl(g)
对上述两个反应的叙述错误的是( )
A.两个反应都是吸热反应
B.都是置换反应
C.都是氧化还原反应
D.都不是离子反应难度: 中等查看答案及解析
-
下列有关化学能与热能的说法正确的是( )
A.CO2+C=2CO是吸热反应,所以化合反应都是吸热反应
B.若某反应的反应物的总能量大于生成物的总能量,则该反应为吸热反应
C.能形成原电池的反应都是放热反应
D.凡经加热而发生的化学反应都是吸热反应难度: 中等查看答案及解析
-
对于工业合成氨反应:N2+3H22NH3,下列说法错误的是( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.反应达到最大限度后,反应就自动停止
D.当NH3的浓度不再改变时,该反应达到最大限度难度: 中等查看答案及解析
-
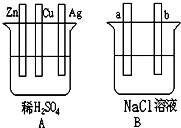
下列装置 所示的实验不能达到目的是( )
A.定量测定化
B.在金属镀件上
C.验证Na和水
D.加热烧杯,分离Sio2
难度: 中等查看答案及解析
-
化学在开发新能源、保护环境等方面有着极其重要作用.下列各项措施中,不利于节能减排和改善环境的是( )
A.加速建设地铁、轻轨等轨道交通,减少汽车尾气排放
B.对聚乙烯等塑料垃圾进行深埋或倾倒入海
C.H2是理想的绿色能源,但最好不用电解水的方法进行获得
D.推广可利用太阳能、风能的城市照明系统难度: 中等查看答案及解析
-
已知:Na2S2O3+H2SO4=S↓+SO2+H2O+Na2SO4,通过析出硫的快慢可以说明反应速率的大小,请判断下列几种情况下,最先看到硫析出的是( )
温度 Na2S2O3溶液的体积和物质的量浓度 H2SO4的体积和物质的量浓度 A 20℃ 15mL0.1mol•L-1 15mL0.1mol•L-1 B 20℃ 10mL0.2mol•L-1 10mL0.2mol•L-1 C 50℃ 50mL0.1mol•L-1 50mL0.1mol•L-1 D 50℃ 5mL0.5mol•L-1 5mL0.5mol•L-1
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列措施是为了降低化学反应速率的是( )
A.把石灰石固体研细后与盐酸反应
B.食品放在冰箱中贮藏
C.用MnO2作H2O2分解反应的催化剂
D.铝和烧碱溶液反应时,稍微加热难度: 中等查看答案及解析
-
关于化学反应中的说法错误的是( )

A.化学反应中有物质变化也有能量变化
B.化学键断裂吸收能量,化学键生成放出能量
C.右图所示的B物质生成A物质的反应为放热反应
D.某可逆反应,若正反应为放热反应,逆反应则是吸热反应难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.在海底高压、低温下形成的晶体CH4•nH2O,俗称“可燃冰”,有可能成为人类未来的重要能源
B.向包有Na2O2的脱脂棉吹气后脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应
C.有的物质即使充分燃烧,其产物也会环境污染
D.核电厂发电时,是将核燃料的化学能转变为电能难度: 中等查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图.下列有关氢氧燃料电池的说法正确的是( )
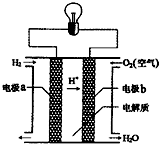
A.该电池的总反应:2H2+O2=2H2O
B.该电池中电极a是正极
C.电极b上发生氧化反应
D.内电路中,H+移向负极难度: 中等查看答案及解析