-
下列关于化学反应与能量变化关系的描述中,说法不正确的是 ( )
A. 化学反应中,吸热反应不一定需要加热也能发生
B. 化学反应中一定有能量变化
C. 放热的反应,不必加热就能发生反应
D. 热化学反应方程式中,热效应数值与反应物的物质的量多少有关
难度: 中等查看答案及解析
-
下列对钢铁制品采取的措施不能防止钢铁腐蚀的是( )
A. 保持表面干燥 B. 表面镀锌 C. 与电源负极相连 D. 表面镶嵌铜块
难度: 中等查看答案及解析
-
下列生产或实验事实引出的相应结论不正确的是( )
选项
事实
结论
A
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短
当其他条件不变时,升高反应温度,化学反应速率加快
B
工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环
增大气液接触面积,使SO3的吸收速率增大
C
在容积可变的密闭容器中发生反应:2NH3(g)
N2H4(l)+H2(g),把容积的体积缩小一半
正反应速率加快,逆反应速率减慢
D
A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
难度: 中等查看答案及解析
-
向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g)
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A. 容器体积不再改变 B. 混合气体的颜色不再改变
C. 混合气体的密度不再改变 D. NO与O2的物质的量的比值不再改变
难度: 中等查看答案及解析
-
在2A+B
3C+4D中,表示该反应速率最快的是( )
A. υ(A) = 0.5mol·L-1·S-1 B. υ(B) =" 0.3" mol·L-1·S-1
C. υ(C) = 0.8mol·L-1·S-1 D. υ(D)=" 1" mol·L-1·S-1
难度: 中等查看答案及解析
-
下列关于铜电极的叙述正确的是 ( )
A. 铜锌原电池中铜电极上发生氧化反应
B. 电解饱和食盐水制烧碱时,用铜作阳极
C. 电解法精炼铜时,粗铜连接电源的正极
D. 电镀铜和精炼铜时,均用纯铜作阴极
难度: 中等查看答案及解析
-
已知:Fe2O3 (s)+3/2C(s)= 3/2CO2(g)+2Fe(s) △H=+234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ,
则 2Fe(s)+3/2O2(g)=Fe2O3(s)的△H是 ( )
A. -824.4kJ·mol- 1 B. -627.6kJ·mol-1
C. -744.7kJ·mol-1 D. -169.4kJ·mol-1
难度: 中等查看答案及解析
-
下列说法中,正确的是 ( )
A. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B. 用铜作电极电解稀硫酸,反应Cu+H2SO4
CuSO4+H2↑可以发生
C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D. 使用催化剂,可加快反应速率,改变反应限度
难度: 中等查看答案及解析
-
下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2
CO+H2O的平衡常数表达式为K==
难度: 中等查看答案及解析
-
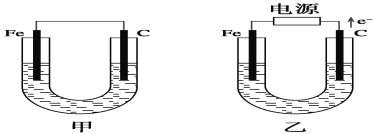
有关如图装置的叙述不正确的是 ( )

A. 这是电解NaOH溶液的装置
B. 该装置中Pt为正极,电极反应为O2+2H2O+4e- = 4OH-
C. 该装置中Fe为负极,电极反应为Fe+2OH-- 2e- = Fe(OH)2
D. 这是一个原电池装置
难度: 中等查看答案及解析
-
已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是
A. 2O3(g)=3O2(g) △H<0 B. 2CO(g)=2C(s)+O2(g) △H>0
C. N2(g)+3H2(g)=2NH3(g ) △H<0 D. CaCO3(s)=CaO(s)+CO2(g) △H>0
难度: 中等查看答案及解析
-
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是 ( )
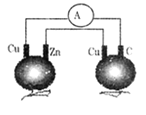
A. 石墨是阴极
B. 两个铜片上都发生氧化反应
C. 锌片是负极
D. 两个番茄都形成原电池
难度: 中等查看答案及解析
-
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
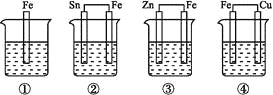
A. ②①③④ B. ④③①② C. ④②①③ D. ③②④①
难度: 中等查看答案及解析
-
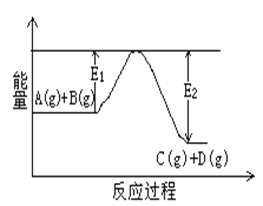
根据反应Br+H2
HBr+H的能量对反应历程的示意图甲进行判断,下列叙述中不正确的是( )
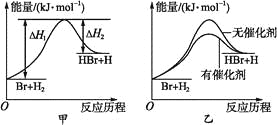
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
某温度时,可逆反应:X(g)+Y(g)
Z(g)的平衡常数K=1.0,若反应物的初始浓度c0(X)=4 mol·L-1,c0(Y)=a mol·L-1,达到平衡后c(Z)=2 mol·L-1。则a为( )
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表: