-
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3
B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布图为
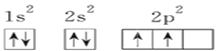
D. Z元素具有两性
难度: 简单查看答案及解析
-
下列有关描述正确的是
A. 第一电离能:B>Be>Li
B. 电负性:F>N>O
C. 前四周期的元素中,未成对电子数等于其电子层数的元素共有5种
D. NH4+与H3O+均为10电子粒子,它们互为等电子体
难度: 中等查看答案及解析
-
在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中的共价键类型是
A. 仅有σ键 B. 三个σ键,两个π键
C. 两个σ键,两个π键 D. 三个σ键,一个π键
难度: 中等查看答案及解析
-
下列对应关系不正确的是
选项
A
B
C
D
中心原子所在族
IVA
VA
IVA
VIA
分子通式
AB4
AB3
AB2
AB2
立体结构
正四面体形
平面三角形
直线形
V形
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 邻羟基苯甲醛的沸点比对羟基苯甲醛的高
B. 由能量最低原理可知,电子总是先排布在s能级上,然后再排p能级
C. CC14、P4和CO2分子中各原子均达到8电子稳定结构
D. 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
难度: 中等查看答案及解析
-
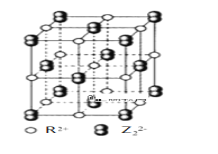
氟在自然界中常以CaF2的形式存在。下列关于CaF2的表述不正确的是
A. CaF2晶体中Ca2+与F-的配位数之比为2:1
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
难度: 中等查看答案及解析
-
碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是:
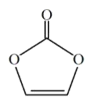
A. 该分子与水分子之间可形成氢键
B. 分子中含6个σ键
C. 分子中氧原子和碳原子的杂化类型相同
D. 该分子为非极性分子
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
B. 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关
C. 金属易导电、易导热、有延展性、易锈蚀均能用金属的电子气理论解释
D. 石墨晶体中既有共价键,又有金属键还有范德华力,是一种混合晶体
难度: 中等查看答案及解析
-
下列关于CH4和CO2的说法不正确的是
A. 固态CO2属于分子晶体,其晶体中每个CO2分子周围有12个分子紧邻
B. CH4、CO2分子中均含有极性共价键,均是非极性分子
C. 因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
难度: 中等查看答案及解析
-
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是

A. 立方相氮化硼含有σ键和π键,所以硬度大
B. 六方相氮化硼层间作用力小,所以质地软
C. 两种晶体中的B原子的杂化类型相同
D. 两种晶体均为分子晶体
难度: 困难查看答案及解析
-
下列说法正确的有几个
①质谱法可用来确定有机物分子中的化学键。 ②电石是混合物。 ③冰醋酸是混合物。 ④脂肪烃是不含支链的链状烃。 ⑤氟氯代烷(商品名氟利昂)常用作制冷剂、灭火剂、溶剂等。 ⑥汽车用丙三醇作防冻液。
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的有几个
① 甲苯 ② 乙醇 ③ 乙烯 ④ 丙烯 ⑤苯酚
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是( )
A. 由溴丙烷一步制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯与酸性高锰酸钾制苯甲酸
C. 由氯代环己烷制环己烯;由丙烯和Br2制
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯制苯甲酸和乙醇
难度: 中等查看答案及解析
-
下列除去杂质的方法正确的几个
① 除去乙烷中少量的乙烯:催化剂条件下通入H2;
② 除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;
③ 除去苯中少量的苯酚:加入足量浓溴水后过滤;
④ 除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
⑤ 除去溴苯中的溴:用汽油萃取
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
鸦片具有复杂的组成,其中的罂粟碱的分子结构如图。鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短。已知该物质的燃烧产物为CO2、H2O和N2,1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是

A. 23.75 mol;5 B. 24.5 mol;7 C. 24.5 mol;8 D. 23.75 mol;4
难度: 中等查看答案及解析
-
由饱和一元醇的两种相邻的同系物组成的3.83g混合物,投入足量的金属钠后,生成0.84L H2(标准状况),该混合物的组成是
A. 甲醇和乙醇 B. 乙醇和丙醇 C. 丙醇和丁醇 D. 甲醇和丙醇
难度: 中等查看答案及解析
-
下列说法正确的是
A. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
B. 苯、苯酚、己烯只用一种试剂就可以鉴别
C.
 用系统命名法叫2-甲基-1-丙醇
用系统命名法叫2-甲基-1-丙醇D. 按系统命名法,
的名称为2,5,6-三甲基-4-乙基庚烷
难度: 中等查看答案及解析
-
2—氨基—5—硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如下图所示,则氨基与硝基直接连在苯环上并呈对位时的红色基B的同分异构体数目为( )
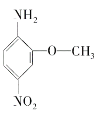
A. 5种 B. 8种
C. 9种 D. 10种
难度: 中等查看答案及解析
-
“苏丹红一号”(结构如下图所示)是一种合成染料,科学家通过经毒理学研究,发现长期食用含有苏丹红的食品对人体可能有致癌因素。下列关于“苏丹红一号”的说法中不正确的是
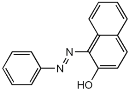
A. 属于芳香族化合物,分子式为C16H12N2O
B. 分子中的所有原子可能位于同一平面上
C. 分子中苯环上的一取代物共有11种
D. 能与NaOH溶液、FeCl3溶液、溴水等物质反应
难度: 困难查看答案及解析
-
下图表示4—溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是
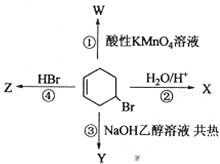
A. ①④ B. ③④ C. ②③ D. ①②
难度: 简单查看答案及解析
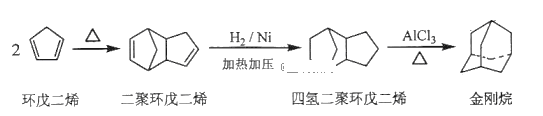
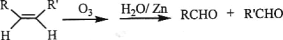

 由环戊二烯和A经Diels-Alder反应制得
由环戊二烯和A经Diels-Alder反应制得 的合成路线流程图,合成路线流程图示例如下:
的合成路线流程图,合成路线流程图示例如下: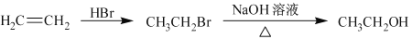
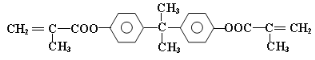
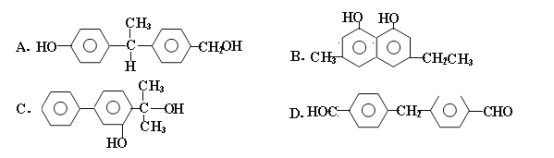
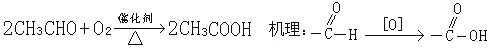
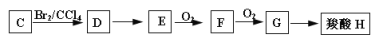


 。
。