-
下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
制备Fe(OH)2
向烧碱溶液中滴加少量FeSO4溶液,搅拌
B
制备无水MgCl2
在空气中蒸干MgCl2 溶液
C
验证新制氯水中含有Cl2
向新制氯水中滴加KI-淀粉溶液
D
除去CO2中的少量SO2
将气体依次通过足量的饱和NaHCO3溶液、足量的浓硫酸
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
V、W、X、Y、Z是原子序数依次增大的短周期主族元素。由V、W、X 和氢元素组成的盐受热分解生成甲、乙、丙三种二元化合物,其中甲是常见的温室气体,乙能使湿润的红色石蕊试纸变蓝色。Y 的焰色反应呈黄色,Z原子最外层有7个电子。下列说法正确的是
A. V、W、X 可分别形成18.个电子的氢化物分子
B. V、W、X 原子的电子层数相同,半径依次增大
C. Z的氧化物对应的水化物的酸性一定比W的强
D. Y分别与X、Z形成的化合物中一定只含离子键
难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关,下列说法正确的是
A. 纳米材料的粒子一般从几纳米到几十纳米(1 nm=10-9m),因此纳米材料属于胶体
B. 稀土元素在科技、生产中有广泛的用途,被誉为新材料的宝库
C. 硫酸铜溶液、饱和硫酸铵溶液均能使蛋白质溶液变性
D. 现代工业生产中芳香烃主要来源于石油的催化裂化和煤的干馏
难度: 简单查看答案及解析
-
下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物
 一定条件下能和6 mol NaOH反应
一定条件下能和6 mol NaOH反应D. 分子式为C4H7ClO2,可与 NaHCO3溶液反应产生CO2的有机物可能结构有6种
难度: 中等查看答案及解析
-
下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
难度: 困难查看答案及解析
-
科学家用X射线激光技术观察容器中某反应,各气态反应物粒子在催化剂表面形成化学键过程的示意图如下图所示。下列关于此反应说法错误的是

A. 该反应既是化合反应,也是氧化还原反应
B. 该反应是可逆反应,若升高温度,反应物平衡转化率降低
C. 一定条件下达到平衡后,若增大压强,则v(正)、v(逆)均增大,且v(正)>v(逆)
D. 该示意图表明反应物粒子先须断裂所有旧化学键,然后形成新化学键
难度: 中等查看答案及解析
-
某化学课题小组将二氧化硫的制备与多个性质实验进行了一体化设计,实验装置如图所示。下列说法不正确的是

A. a、b、c中依次盛装70%硫酸.Na2SO3固体、NaOH溶液
B. 实验时,湿润的pH试纸、鲜花、品红溶液、KMnO4溶液均褪色,Na2S溶液出现淡黄色沉淀
C. 此设计可证明SO2水溶液的酸性,SO2的氧化性、还原性、漂白性
D. 点燃酒精灯加热,可证明SO2使品红溶液褪色具有可逆性,使KMnO4溶液褪色不具有可逆性
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是( )
A. 测0.1mol/L氨水的pH为11:NH3·H2O
NH4++OH-
B. 将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
D. Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
难度: 中等查看答案及解析
-
为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是
A. 铁皮未及时取出,会导致测定结果偏小
B. 铁皮未洗涤干净,会导致测定结果偏大
C. 烘干时间过长,会导致测定结果偏小
D. 若把盐酸换成硫酸,会导致测定结果偏大
难度: 中等查看答案及解析
-
为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是
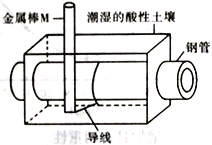
A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M 将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 金属棒M 与钢管用导线连接后可使钢管表面的腐蚀电流接近于零
难度: 中等查看答案及解析
-
常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
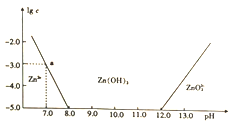
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
难度: 中等查看答案及解析
-
工业上常用铁碳混合物处理含CuSO4废水获得金属铜。当休持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时问变化的曲线如图所示。下列推论不合理的是

A. 由图可知,活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁屑为负极
C. 利用铁碳混合物回收含CuSO4废水中铜的反应原理:Fe+CuSO4=FeSO4+Cu
D. 增大铁碳混合物中铁碳质量比(x),一定会提高废水中Cu2+的去除速率
难度: 中等查看答案及解析
-
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
难度: 困难查看答案及解析
-
高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示。下列叙述错误的是

A. 已知H3FeO4+的电离半衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pII=4吋,溶液中

B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 向pH=5的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4ˉ+OHˉ=FeO42-+H2O
D. pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)> c (HFeO4ˉ)
难度: 中等查看答案及解析