-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A. 常温常压下X的单质为气态
B. Z的氢化物为离子化合物
C. Y和Z形成的化合物的水溶液呈碱性
D. W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A. CO2的电子式:
B. 质量数为37的氯原子:
l
C. NH4Cl的电子式:
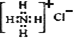 D. 原子核内有10个中子的氧原子:
D. 原子核内有10个中子的氧原子:难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 化学能可以转变成为热能、电能等
B. 化学反应必然伴随发生能量变化
C. 化学反应中的能量变化主要是由化学键的变化引起的
D. 化学反应中能量变化的多少与反应物的质量无关
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 原子及其离子的核外电子层数等于该元素所在的周期数
B. 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C. 第ⅠA族元素的金属性比第ⅡA族元素的金属性强
D. 在周期表里,主族元素所在的族序数等于原子核外电子数
难度: 中等查看答案及解析
-
某元素的一种核素X 的质量数为A,含N个中子,它与1H 原子组成HmX 分子。在a g HmX中所含质子的物质的量是
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
下表给出了X、Y、Z、W四种短周期常见元素的部分信息,请根据这些信息判断下列说法中正确的是( )
元素
X
Y
Z
W
原子半径(nm)
0.102
0.130
0.073
0.071
最高正价或最低负价
+6
+2
-2
-1,W无正价
A. HW水溶液可以保存在玻璃瓶中 B. X的单质与Z的单质反应生成XZ3
C. Z的最高正价为+6 D. 原子序数X>Y>W>Z
难度: 中等查看答案及解析
-
元素砹(At)原子序数为85,下面关于该元素说法不正确的是( ).
A. AgAt 不溶于水 B. HAt很不稳定
C. At的单质是白色固体 D. 该元素位于元素周期表第六周期、第十七列
难度: 简单查看答案及解析
-
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
难度: 简单查看答案及解析
-
可逆反应:2NO2(g)
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B. ②③⑤ C. ①③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
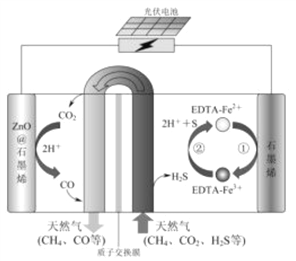
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
难度: 中等查看答案及解析
-
下列实验中,可以加快反应速率的是( )
A. 钠与水反应时,增加水的量
B. 锌与稀硫酸反应时,加入少量CuSO4固体
C. 用18mol/L的硫酸溶液代替 2mol/L硫酸溶液常温下与铝反应
D. 合成氨反应,恒容通入氦气
难度: 中等查看答案及解析
-
某温度时,浓度都是1 mol / L的两种气体X2、Y2在密闭容器中反应生成气体Z
达平衡后,c (X2)为0.4 mol / L,c (Y2)为0.8 mol / L,生成c (Z)为0.4 mol / L,则该反应的反应式(z用x、y表示)是( )
A. X2 + 2Y2
2XY2 B. 2X2 + Y2
2X2Y
C. 3X2 + Y2
2X3Y D. X2 + 3Y2
2XY3
难度: 中等查看答案及解析
-
磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
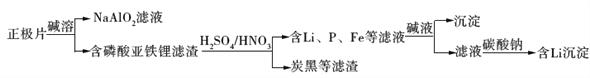
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g) ⇌ 2HI(g) 达到平衡状态时的标志是( )
A. 混合气体的体积恒定不变
B. 混合气体的颜色不再改变
C. 混合气的平均摩尔质量不变
D. I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
难度: 中等查看答案及解析
-
下列关于化学键说法正确的是( )
A. 构成单质分子的微粒中不一定含有化学键
B. 只含有共价键的物质一定是共价化合物
C. NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D. CaCl2 中既有共价键又有离子键
难度: 中等查看答案及解析
-
在 2L密闭容器中发生反应N2+3H2 ⇋ 2NH3,经一段时间后NH3 的物质的量增加了2.4 mol,这段时间内用氢气表示的反应速率为0.6mol/(L·s),则这段时间为( )
A. 6 s B. 4 s C. 3 s D. 2 s
难度: 中等查看答案及解析