-
下列说法不正确的是
A. 储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C. 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性
D. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
B. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键
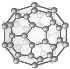
C. 28 g N60单质(见图)中含有的N-N(σ)键个数为3NA
D. 235g核互
发生裂变反应:
+
+
+10
,净产生的中子(n)数为10NA
难度: 中等查看答案及解析
-
下列叙述不正确的是
A. 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
B. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
C. 过滤操作中,漏斗的尖端应接触烧杯内壁
D. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式不正确的是
A. 离子方程式2Ca2+ +3HCO3–+3OH–→2CaCO3↓+CO32–+3H2O可以表示Ca(HCO3)2与NaOH溶液反应
B. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
C. CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
D. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. X的简单氢化物的热稳定性比W的强
B. 简单离子半径大小顺序为X>Y
C. X的电负性和第一电离能都大于W
D. Z与X属于同一主族,与Y属于同一周期
难度: 中等查看答案及解析
-
通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是
①C(s) + H2O(g)==CO(g) + H2 (g) ΔH1 = akJ·mol−1
②CO(g) + H2O(g)==CO2(g) + H2 (g) ΔH2 = bkJ·mol−1
③CO2 (g) + 3H2 (g)==CH3OH(g) + H2O(g) ΔH3 = ckJ·mol−1
④2CH3OH(g)==CH3OCH3 (g) + H2O(g) ΔH4 = dkJ·mol−1
A. 反应①、②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
CH3OCH3 (g) +
H2O(l)的ΔH =
kJ·mol−1
D. 反应2CO(g) + 4H2 (g)==CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol−1
难度: 简单查看答案及解析
-
在一定条件下,向2 L密闭容器中加入2 mol X、1 mol Y。发生如下反应:2X(g)+Y(?)
3Z(g) ∆H<0。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法正确的是
A. 反应开始至平衡时,用X表示的化学反应速率为1.2 mol/(L·min)
B. 该反应平衡常数表达式一定是K=c3(Z)/[c2(X)c(Y)]
C. 若再充入1 mol Z,重新达平衡时X的体积分数一定增大
D. 若使容器体积变为1 L,Z的物质的量浓度一定增大
难度: 中等查看答案及解析
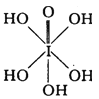 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)