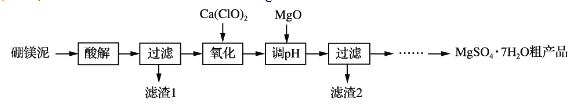
-
化学与生活密切相关。下列说法不正确的是( )
A. 研究海水淡化技术以缓解淡水资源紧缺问题
B. 燃煤中加入CaO主要是为了减少CO2气体排放
C. 绿色化学要求从源头上消除或减少生产活动对环境的污染
D. 研制高性能的耐磨轮胎,可以减少PM2.5等颗粒物的产生
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 质量数为37的氯原子:
Cl B. 间甲苯酚的结构简式:

C. F-的结构示意图:
D. 硫化氢的电子式:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A. 晶体硅的熔点高、硬度大,可用作半导体材料
B. 浓H2SO4具有脱水性,可用来干燥HCl
C. 明矾易溶于水,可用作净水剂
D. Na具有强还原性,可用于高温下与TiCl4反应制备Ti
难度: 简单查看答案及解析
-
下列装置或原理能达到实验目的的是( )
A. 制取氯气
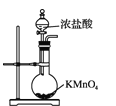 B. 除去氯气中的氯化氢
B. 除去氯气中的氯化氢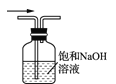 C. 氯气的尾气处理
C. 氯气的尾气处理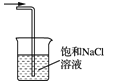 D. 测氯水的pH
D. 测氯水的pH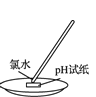
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X的简单氢化物常用作制冷剂,Z的原子半径是所有短周期主族元素中最大的。Y和W同主族且W的原子序数是Y的两倍。下列说法正确的( )
A. X的简单氢化物的热稳定性比Y的强
B. Z与W形成化合物的水溶液可使蓝色石蕊试纸变红
C. 由Y、Z两种元素组成的化合物中可能含共价键
D. 离子半径的大小顺序:r(W2-)>r(Z+)>r(Y2-)>r(X3-)
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 醋酸溶解水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
B. 铜与稀硝酸反应:3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O
C. 用热的NaOH溶液溶解S:3S+4OH-
2S2-+SO2↑+2H2O
D. 向氨水中通入过量SO2:2NH3·H2O+SO2===2NH
+SO32—+H2O
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2
SiCl4
Si B. CuSO4
Cu(OH)2
Cu
C. 饱和NaCl(aq)
NaHCO3(s)
Na2CO3(s) D. FeS2(s)
SO3(g)
H2SO4
难度: 简单查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明溶液中:Ba2+、Fe3+、Cl-、NO3—;
B. 能使酚酞变红的溶液中:Ca2+、K+、HCO3—、CO32—
C. 0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO3—
D.
=10-12的溶液中:NH
、Cu2+、NO3—、SO42—
难度: 中等查看答案及解析
-
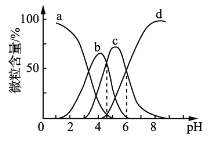
下列图示与对应的叙述相符的是( )
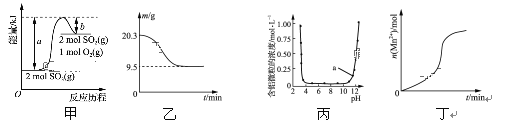
A. 由图甲可知,2SO3(g)
2SO2(g)+O2(g) ΔH=(b-a)kJ·mol-1
B. 图乙表示0.1 mol MgCl2·6H2O在空气中充分加热时残留固体质量随时间的变化
C. 图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中存在大量Al3+
D. 图丁表示10 mL 0.01 mol·L-1酸性KMnO4溶液与过量的0.1 mol·L-1的H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对反应有催化作用)
难度: 中等查看答案及解析
-
下列说法正确的是( )
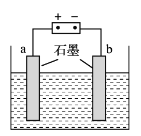
A. 合成氨反应是放热反应,所以工业上采用低温条件以提高氨的产率
B. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法延缓其腐蚀
C. Na2O2与水反应产生1 mol O2,理论上转移的电子数约为4×6.02×1023
D. 保持温度不变,向稀氨水中缓慢通入CO2,溶液中
的值增大
难度: 中等查看答案及解析
-
根据实验操作和现象所得出的结论正确的是 ( )
选项
实验操作和现象
结论
A
向NaI溶液中滴入少量新制氯水和苯,振荡、静置,溶液上层呈紫色
I-还原性强于Cl-
B
向某溶液中滴加H2O2溶液后再加入KSCN,溶液呈红色
溶液中一定含有Fe2+
C
测定等浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的pH大于Na2SO3溶液
S的非金属性比C强
D
向蔗糖溶液中加入少量稀硫酸并加热,冷却,加入新制Cu(OH)2悬浊液,加热,未出现红色沉淀
蔗糖未水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
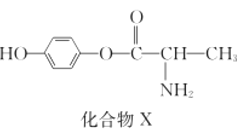


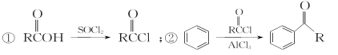 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备