-
柠檬酸是常见的食品添加剂,其结构式如下图所示。以下叙述正确的是:( )
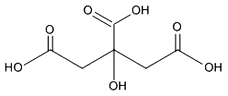
A. 柠檬酸分子式为C6H9O7
B. 使用食品添加剂属于违法行为
C. 柠檬酸可用作食品抗氧化剂,说明其有较强氧化性
D. 柠檬酸分子含三个羧基(-COOH)
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. 钠与水反应:2Na + 2H2O = 2Na+ + 2OH- + H2↑
B. 纯碱溶液去油污:CO32- + H2O = HCO3- + OH-
C. Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D. 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-=BaSO4↓+AlO2-+2H2O
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同周期。甲、乙、己是由这些元素组成的二元化合物。 0.001 mol•L-1 的己溶液pH为3;庚是具有漂白性的混合物。上述物质的转化关系如图所示。下列说法正确的是:( )
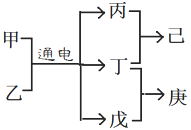
A. 原子半径Z>Y>X
B. 仅由这四种元素构成的溶液可能呈酸性、碱性或中性
C. 己为由极性键构成的非极性分子
D. 戊为一元弱碱
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
用pH试纸检测:0.1mol·L-1Na2SO3溶液、0.1mol·L-1NaHSO3溶液
Na2SO3溶液的pH约为10; NaHSO3溶液的pH约为5
HSO3-结合H+的能力比SO32-强
B
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体
溶液红色变浅
Na2CO3溶液中存在水解平衡
C
注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半
气体颜色比起始时浅
加压后,NO2转变为无色的N2O4
D
饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸
沉淀部分溶解且有气体产生
Ksp(BaSO4) >Ksp(BaCO3)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
中国研究人员成功开发出一款锂-氮可充电电池,该电池系统由锂电池阳极、可传递Li+的醚类电解质、碳布阴极组成,其原理为6Li+N2=2Li3N 。以下说法合理的是
A. 放电时Li+由正极移向负极
B. 也可以用氯化锂水溶液做电解质传递Li+
C. 放电时正极反应:6Li+ + N2 + 6e- = 2Li3N
D. 充电是固氮过程
难度: 中等查看答案及解析
-
已知:Ksp[Fe(OH)3]=4.0×10-36 。c(Fe3+)=4.0×10-3mol·L-1的溶液中,搅拌的同时向该溶液中滴加浓氨水,当开始出现氢氧化铁沉淀时,溶液的pH为
A. 12 B. 11 C. 4 D. 3
难度: 简单查看答案及解析
-
25℃时,pH=2的HA和HB各1 mL分别加水稀释,pH随溶液体积变化如图所示。下列叙述不正确的是( )
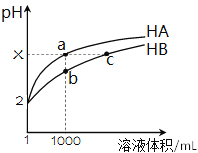
A. 若X=5则HA为强酸
B. 将a点与b点两溶液同时升高温度,则
减小
C. 由b到c, Kw不变
D. a、c两溶液中n(H+)相等
难度: 简单查看答案及解析



 )可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
)可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。 B……
B……