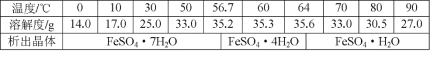
-
下列叙述错误的是
A. 维生素C又称“抗坏血酸“,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有抗氧化性
B. 我国科学家屠呦呦因发现了一种可以有效降低疟疾患者死亡率的药物-青蒿素而获得2015年诺贝尔生理学或医学奖
C. 葡萄糖主要用于食品加工、医疗输液、合成补钙及维生素C等;淀粉可用于药片的赋形剂
D. 有机三大合成材料是指塑料、合成橡胶和合成纤维,它们都主要是以煤、石油和天然气为原料生产的
难度: 简单查看答案及解析
-
实验室制备下列气体时,所用方法及相关说法正确的是
A. 制氨气时,可直接加热氯化铵或者碳酸氢铵固体
B. 制氯气时,可用二氧化锰与浓盐酸加热制得
C. 制乙炔时,可用电石和饱和食盐水反应,所得气体能使酸性高锰酸钾溶液紫红色褪去,证明乙炔具有还原性
D. 制二氧化硫时,可用硫代硫酸钠和稀硝酸反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在酸性溶液中Fe3+、NH4+、SCN-、NO3-和MnO4-可以大量共存
B. SO2通入溴水中,反应的离子方程式为SO2+Br2+2H2O═SO32-+2Br -+4H+
C. 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D. 为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率,同时可以加快正反应速率
B. 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大
C. 用惰性电极电解K2SO4溶液,阴极产物和阳极产物的物质的量之比为1:2
D. 镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀
难度: 中等查看答案及解析
-
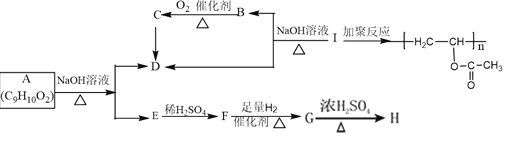
下列有关有机物的描述不正确的是
A. 有机物
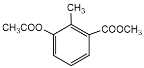 的核磁共振氢谱图中有4种类型的氢原子吸收峰
的核磁共振氢谱图中有4种类型的氢原子吸收峰B. 用FeCl3溶液可以鉴别苯、苯酚、四氯化碳、KSCN、乙醇和AgNO3六种无色溶液或液体
C. 有机反应
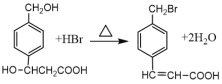 涉及取代反应和消去反应两种类型
涉及取代反应和消去反应两种类型D. 1 mol
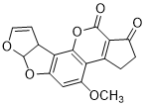 一定条件下最多可以与6 mol H2反应
一定条件下最多可以与6 mol H2反应难度: 中等查看答案及解析
-
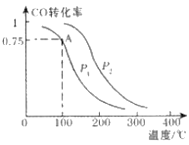
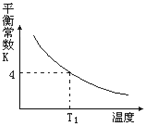
T2℃时,将1 mol X和2 mol Y投入2L的密闭容器中,发生反应:X(g)+2Y(g)
3Z(g)ΔH,测得X、Y的量随时间变化如下表,平衡时物质X的体积分数为φ,该反应的平衡常数(K)随温度的变化如下图,则下列判断正确的是
0
1
2
3
4
5
6
X
1
0.80
0.66
0.58
0.52
0.50
0.50
Y
2
1.60
A. 前5 min用Z表示的平均反应速率为1.2mol/(L·min)
B. T2℃时,对于反应1/2X(g)+Y(g)
3/2Z(g) △H’ 2ΔH’=ΔH
C. T2℃时,若以1mol X、2mol Y和1mol Z充入上述容器中,达到平衡时X的体积分数比φ大
D. 该反应的正反应是吸热反应,且T1<T2
难度: 困难查看答案及解析
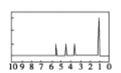 ,则乙的名称为______________
,则乙的名称为______________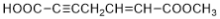 )分子中最多有_____个原子在同一平面内
)分子中最多有_____个原子在同一平面内