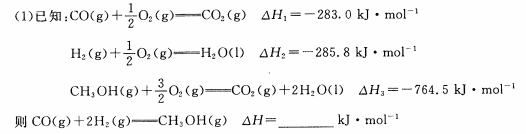-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1) 已知:CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=____________kJ·mol-1
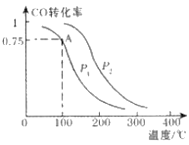
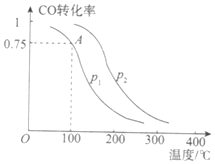
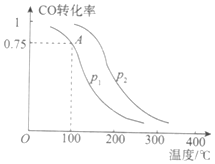
(2)一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇 平衡转化率与温度、压强的关系如右图所示。
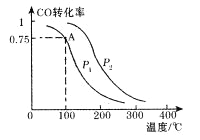
①在2 min时测得容器内甲醇的浓度为0.25 mol·L-1,则0-2 min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>” 、“<” 或“=” ),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。(填写相 应字母)
A、使用高效催化剂 b、降低反应温度 c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
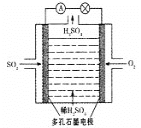
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
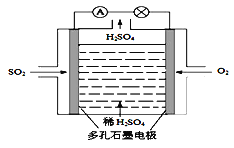
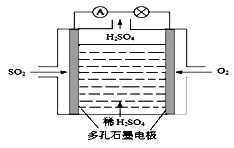
(3)原电池法:
该小组设计的原电池原理如右图所示。
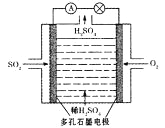
该电池中右侧为________极,写出该电池负极的电极反应式 ____。
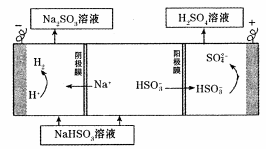
(4)电解法:
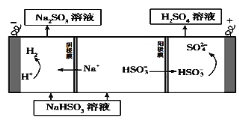
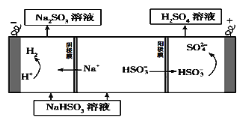
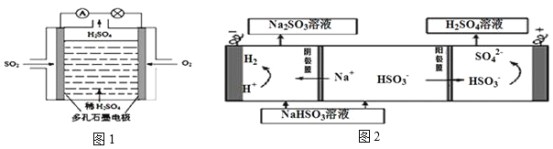
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右图所示。
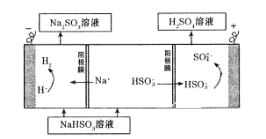
写出开始电解时阳极的电极反应式____________________
-
(14分)CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
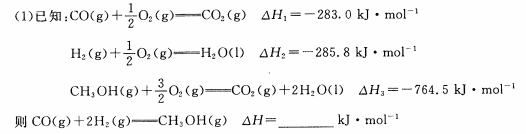
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图所示。
①P1__P2(填“>”、“<”或“=”),理由是
②该甲醇合成反应在A点的平衡常数K= (用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO H2(填“>” 、“<” 或“=” )
④下列措施中能够同时满足增大反应速率和提高CO转化率的是 。(填写相应字母)
A、使用高效催化剂
B、降低反应温度
C、增大体系压强
D、不断将CH30H从反应混合物中分离出来
E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:该小组设计的原电池原理如图所示。写出该电池负极的电极反应式 。
(4)电解法:该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如下图所示。
写出开始电解时阳极的电极反应式 。
-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.
①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。
(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.
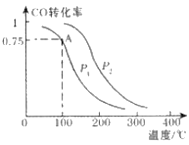
①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。
(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
-
CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2 CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。
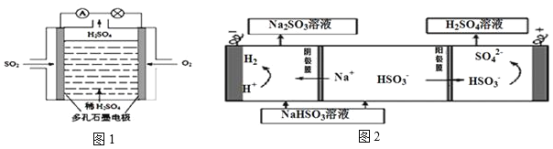
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
| 预测 | 实验操作 | 实验现象 |
| 探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
| 探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
-
CO、SO2是大气污染气体,利用化学反应是治理污染的重要方法。
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇:CO+2H2 CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。一定条件下,在容积为VL的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
(1)下列能说明反应达到平衡状态的是_______(填序号)。
①v逆(CO)=2v正(H2)
②c(CO)=c(CH3OH)
③混合气体的平均相对分子质量不变
④单位时间内生成2n mol H2的同时生成n mol CH3OH
(2)该反应在A点的平衡常数K_________(用a和V表示)。
(3)写出既能增大v(CO)又能提高CO转化率的一项措施:________。
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(4)原电池原理:该小组设计的原理示意图(如图1所示),写出该电池正极的电极反应式_______。
(5)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸(原理如图2所示)。写出开始电解时阳极的电极反应式_______。
Ⅲ.硫代硫酸钠(Na2S2O3)俗称大苏打,有着广泛的用途。用SO2可制Na2S2O3。某小组同学制备、预测并探究硫代硫酸钠的性质(反应均在溶液中进行)。
| 预测 | 实验操作 | 实验现象 |
| 探究1 | Na2S2O3溶液呈碱性 | 把pH试纸放在玻璃片上,用玻璃棒蘸取溶液滴在试纸上 | pH=8 |
| 探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 黄绿色颜色变浅,甚至褪去 |
(6)分析SO2能制备Na2S2O3的理论依据是_________。
(7)用离子方程式表示Na2S2O3溶液具有碱性的原因_________。
(8)探究2反应的离子方程式为_________。
-
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g) CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
| 化学键 | H—H | O=O | O—H |
| 键能/KJ▪mol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
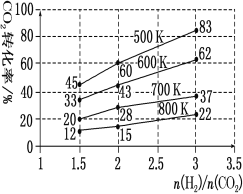
①降低温度,平衡向____方向移动。
②在700K、起始投料比 =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比 =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH3CH2OH的浓度为___。
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH3CH2OH的浓度为___。
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。
-
甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题
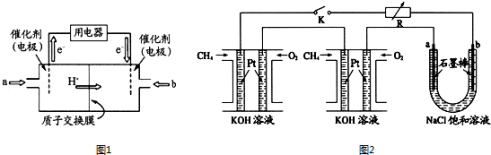
(1)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图1所示:通入a气体的电极是原电池的 极(填“正”“负”),其电极反应式为 .
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示U形管中氯化钠溶液的体积为800ml.闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 .
-
运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)乙醇是一种重要的燃料,工业上利用乙烯制酒精:C2H4(g)+H2O(l)=C2H5OH(l) ΔH,已知乙烯、乙醇的燃烧热分别是1411.0kJ·mol-1、1366.8 kJ·mol-1,则ΔH=_____________。
(2)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g) CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
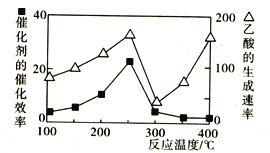
①200~250℃时,乙酸的生成速率升高的主要原因是____________________________。
②300~400℃时,乙酸的生成速率升高的主要原因是____________________________。
(3)甲醇作为一种重要的化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为CH3OH(g)+CO(g) HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
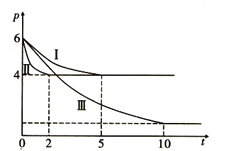
①Ⅱ和Ⅰ相比,Ⅱ中改变的反应条件是_______________________。
②Ⅲ和Ⅰ相比,Ⅲ中改变的反应条件是_________________,判断的理由是________________________。
③反应Ⅰ在5min 时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= ________________。
④反应Ⅱ在2min 时达到平衡,平衡常数K(Ⅱ)= ______________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入2mol CH3OH 和1mol HCOOCH3后,平衡_______移动(填“正向”“逆向”或“不”),原因是____________________________________________。
-
开发新能源是解决大气污染的有效途径之一。燃料电池由于能量转化率高.可作为常规能源的替代品而越来越受到关注。
(1)直接甲醇燃料电池(简称DMFC)结构简单、对环境无污染,其工作原理如图所示。
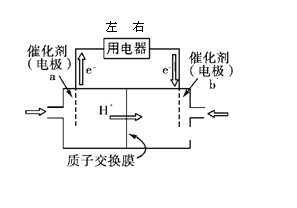
① 外电路电子从用电器_____(填“左端”、或“右端”)进人,b 极电极反应式为______;
② 有1.5mol电子通过用电器,则消耗的甲醇质量为______。
(2)一种用于驱动潜艇的液氨-液氧燃料电池的原理如图所示。
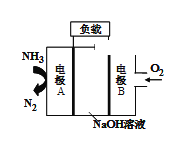
①电极B发生_______(填“氧化”或 “还原”)反应,电池工作时,OH-移向_____(填“A极”或“B极”)。
②电极A的电极反应式为____________。
(3)赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S == 6Cu+SO2↑在该反应中,氧化剂是:___________ 还原剂是:___________ 每当有0.3mol电子通过时,生成的铜的物质的量为 ___________mol 生成的SO2 在标况下的体积为_________ L