-
将一块铁片放入0.5L 1mol/L CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,则反应后溶液中CuSO4的物质的量浓度是(反应前后溶液的体积不变)
A. 0.9 mol/L B. 0.85 mol/L C. 0.8 mol/L D. 0.75 mol/L
难度: 中等查看答案及解析
-
同温、同压下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A. 所含分子数目相同 B. 所含氢原子物质的量之比为3:4
C. 质量之比为16:17 D. 密度之比为17:16
难度: 简单查看答案及解析
-
在酸性条件下,可发生如下反应:ClO3— + 2M3++ 4H2O = M2O7n— + Cl— + 8H+,M2O7n— 中M的化合价是
A. +4 B. +5 C. +6 D. +7
难度: 中等查看答案及解析
-
下列过程没有发生化学反应的是( )
A. 生石灰作干燥剂 B. 氢氟酸刻蚀玻璃
C. 打磨磁石制指南针 D. 用含硅胶、铁粉的透气小袋与食品一起密封包装
难度: 中等查看答案及解析
-
下列配制溶液的操作中,有可能不会影响所配溶液浓度大小的是( )
A. 用量筒量取浓溶液后,将量筒中残留的液体洗净倒入烧杯中
B. 定容时俯视
C. 称量时误用“左码右物”
D. 定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴加蒸馏水至刻度线
难度: 中等查看答案及解析
-
下列实验操作中所用仪器合理的是( )
A. 用100mL的量筒量取18.8mLNaOH溶液
B. 用瓷坩埚加热熔融NaOH
C. 用托盘天平称取25.20g氯化钠
D. 用100mL容量瓶配制70mL0.1mol/L盐酸
难度: 中等查看答案及解析
-
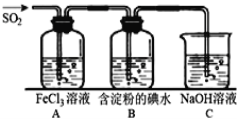
根据SO2通入不同溶液中实验现象,所得结论不正确的是
溶液
现象
结论
A
含HCl、BaCl2的
溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 1 mol氢约含有6.02×1023个粒子 B. H2的摩尔质量是2 g
C. 1mol O2的质量是32 g,含有的氧原子数为2NA D. 铁的摩尔质量等于铁原子的相对原子质量
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 硅是良好的半导体材料,且是制造光缆的主要材料
B. 新制氯水经光照一段时间pH减小
C. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
D. 将过量的NaOH溶液逐滴滴入AlCl3溶液中,先无明显现象后出现白色絮状沉淀
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 将过量的稀盐酸逐滴滴入稀Na2CO3溶液中,立即产生气体
B. FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路
C. Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性
D. 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 92gNO2和N2O4混合气体中含有的原子数为3NA
B. 71g氯气与足量铁粉充分反应,转移的电子数为3 NA
C. 0.5mol·L-1的Ba(OH)2溶液中OH-的数目为NA
D. 1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的碳原子数为2NA
B. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C. 1 molFe溶于过量硝酸,电子转移数为2NA
D. lmol FeI2与足量氯气反应时转移的电子数为2NA
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,5.6LO2含有4NA个电子
B. 28gN2、CO和C2H4的混合气体分子总数为NA
C. 标准状况下,22.4L盐酸含有NA个HCl分子
D. 1molNa被完全氧化生成Na2O2,失去2NA个电子
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 无色透明的溶液中: Fe3+、Mg2+、SCN –、Cl –
B. Kw/c(H+)=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 向NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
B. Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. 氯气溶于水:Cl2+H2O=H++Cl-+HClO
难度: 中等查看答案及解析
-
能正确表示下列反应的离子反应方程式为( )
A. Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3- +Ca2++OH-===CaCO3↓+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓
C. 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. MnO2 与浓盐酸反应制Cl2:MnO2+4HCl=Mn2++2Cl-+Cl2↑+2H2O
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是( )
A. SF6是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子
D. 还原剂与氧化剂的物质的量之比为4:1
难度: 中等查看答案及解析
-
下列关于胶体的叙述不正确的是( )
A. 胶体区别于其他分散系的本质特征是分散质的微粒直径在10﹣9~10﹣7m之间
B. 胶体是一种均一、稳定的纯净物
C. 用平行光照射CuSO4溶液和Fe(OH)3胶体时,产生的现象不相同
D. 向沸水中逐滴加入FeCl3饱和溶液,继续煮沸至液体呈红褐色,制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
将Cl2通入400mL0.5 mol·L-1KOH溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1:2,则通入的Cl2在标谁状况下的体积为( )
A. 1.12L B. 2.24L C. 1.68L D. 0.56L
难度: 简单查看答案及解析
-
如果ag某气体中含有的分子数为b,则cg该气体的物质的量是( )
A. bc/(aNA)mol B. ac/(bNA)mol C. ab/(cNA)mol D. b/(acNA)mol
难度: 中等查看答案及解析
-
质量相同的镁和铝,跟足量的盐酸反应,失去电子数之比为 ( )
A. 1∶1 B. 2∶3 C. 24∶27 D. 3∶4
难度: 中等查看答案及解析