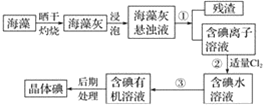
-
将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为
A. 5a/b mol·L-1 B. b/5a mol·L-1 C. 10a/b mol·L-1 D. a/b mol·L-1
难度: 简单查看答案及解析
-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
难度: 简单查看答案及解析
-
在反应X + 2Y =" R" + 2M中,已知R和M的摩尔质量之比为22∶9,当1.6g X与Y完全反应后,生成4.4g R。则此反应中Y和M的质量之比为( )
A. 16∶9 B. 23∶9 C. 32∶9 D. 46∶9
难度: 困难查看答案及解析
-
下列溶液中溶质的物质的量浓度为1 mol·L-1的是
A. 将58.5 g NaCl溶解于1 L水中配成的溶液
B. 将80 g SO3溶于水并配成1 L溶液
C. 将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 含K+为2 mol的K2SO4溶液
难度: 简单查看答案及解析
-
根据所给的信息和标志,判断下列说法错误的是( )
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片


古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
进行化学实验必须注意安全,下列说法正确的是( )
A. 若用蒸馏水润湿过的pH试纸检测某溶液的pH,pH值一定有误差。
B. 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液
C. 将胶头滴管垂直伸进试管内滴加液体
D. 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸
难度: 简单查看答案及解析
-
用下列实验装置或操作进行相应实验,能达到实验目的的是( )
A. 用图所示装置制取少量纯净的CO2气体
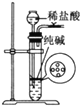
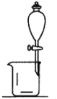
B. 如图所示,用CCl4提取溴水中的Br2
C. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
D. 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
难度: 简单查看答案及解析
-
科学家刚刚发现了某种元素的原子,其质量是a g,一个12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A. 该原子的摩尔质量是a•NA
B. w g该原子的物质的量一定是w/(a•NA) mol
C. w g该原子中含有(w/a)×NA个该原子
D. 由已知信息可得:NA=12/a
难度: 简单查看答案及解析
-
今有X、Y、Z、W四种无色溶液,分别是盐酸、硝酸钡、碳酸钠、硝酸银中的一种。两两之间相互反应的现象如下表:
X
Y
Z
W
Y
↑
-
↓
无明显现象
Z
↓
↓
-
无明显现象
试判断X、Y、Z、W依次是
A. Na2CO3、HCl、Ba(NO3)2、AgNO3 B. HCl、Na2CO3、AgNO3、Ba(NO3)2
C. AgNO3、Ba(NO3)2、HCl、Na2CO3 D. Na2CO3、HCl、AgNO3、Ba(NO3)2
难度: 简单查看答案及解析
-
以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是
A. 有CO、CO2、O3三种气体,它们各含有1 mol O,则三种气体物质的量之比为3:2:1
B. n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C. 常温下,a L氧气和氮气的混合物含有的分子数就是(a/22.4)×6.02×1023个
D. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 与V L CO具有相同分子数的CO2的体积一定是V L
B. 标准状况下,22.4 L氧气、氮气和CO的混合气体中含有2NA个原子
C. 1 mol NaCl中含有6.02×1023个NaCl分子
D. 所含原子数相等的CO与CO2的密度之比为21:22
难度: 简单查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol•L﹣1,c(K+)=0.6 mol•L﹣1,c(SO42﹣)=0.8 mol•L﹣1,则c(Al3+)为
A. 0.1 mol•L﹣1 B. 0.3 mol•L﹣1 C. 0.6 mol•L﹣1 D. 0.9 mol•L﹣1
难度: 简单查看答案及解析
-
草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )。
A.
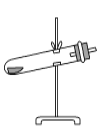 B.
B. 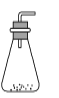 C.
C. 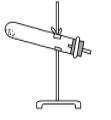 D.
D. 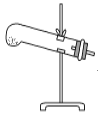
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
B. 在常温常压下,18 g H2O与18 g D2O所含电子数均为10NA
C. 常温常压下,92g 的NO2和N2O4混合气体含有的原子数为6NA
D. 常温常压下,22.4 L 氯气与足量的镁粉充分反应,转移的电子数为2NA
难度: 简单查看答案及解析
-
下列实验操作中,不合理的是( )

A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
难度: 中等查看答案及解析
-
实验室用向下排空气法收集氨气,测得瓶内气体在在同温同压下的与氢气的密度比为10,则所得气体中氨气与空气的体积比为( )
A. 3:1 B. 1:2 C. 1:3 D. 3:2
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等
B. 任何条件下,等物质的量的甲烷(CH4)和一氧化碳,体积一定相同
C. 同温同压下的一氧化碳气体和氮气,若体积相等,则质量一定相等
D. 从1 L 0.5 mol·L-1 NaCl溶液中取出100 mL,剩余溶液中NaCl物质的量浓度为0.45 mol/L
难度: 简单查看答案及解析
-
等物质的量的Fe,Mg,Al分别与足量的物质的量浓度相同的盐酸完全反应,消耗盐酸的体积比为
A. 2:3:1 B. 2:2:3 C. 3:2:1 D. 1:3:2
难度: 中等查看答案及解析