-
在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是( )
A. pH=3的HNO3和pH=11的KOH
B. pH=3的盐酸和pH=11的氨水
C. pH=3的醋酸和pH=11的Ba(OH)2
D. pH=3的硫酸和pH=11的NaOH
难度: 中等查看答案及解析
-
下列有关滴定操作的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D. 用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
难度: 简单查看答案及解析
-
常温下,下列关于NaOH溶液和氨水的说法正确的是
A. 相同物质的量浓度的两溶液中的c(OH-)相等
B. pH=13的两溶液稀释100倍,pH都为11
C. 两溶液中分别加入少量NH4Cl固体,c(OH-)均减小
D. 体积相同、pH相同的两溶液能中和等物质的量的盐酸
难度: 简单查看答案及解析
-
已知电离平衡常数K1(H2SO3)> K1(H2CO3)≈K2(H2SO3)>K2(H2CO3),则溶液中不可以大量共存的离子组是
A. SO32—、HCO3— B. HSO3—、HCO3— C. HSO3—、CO32— D. SO32—、CO32—
难度: 中等查看答案及解析
-
已知:Fe2O3 (s)+3/2C(s)= 3/2CO2(g)+2Fe(s) △H=+234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ,
则 2Fe(s)+3/2O2(g)=Fe2O3(s)的△H是 ( )
A. -824.4kJ·mol- 1 B. -627.6kJ·mol-1
C. -744.7kJ·mol-1 D. -169.4kJ·mol-1
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 化学能可以转变成为热能、电能等
B. 化学反应必然伴随发生能量变化
C. 化学反应中的能量变化主要是由化学键的变化引起的
D. 化学反应中能量变化的多少与反应物的质量无关
难度: 简单查看答案及解析
-
下列物质中属于弱电解质的是
A. 冰醋酸 B. H2SO4溶液 C. BaSO4 D. Cl2
难度: 简单查看答案及解析
-
pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比( )
A. 11 :1 B. 9 :1 C. 1 :11 D. 1 :9
难度: 简单查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是( )
A. CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B. S(s)+3/2O2(g)=SO3(s) △H2
C. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D. 2CO(g)+O2(g)=2CO2(g) △H4
难度: 中等查看答案及解析
-
已知:S(g) + O2 (g) = SO2(g) ΔH=-Q1kJ/mol ; S(s) + O2 (g) = SO2(g) ΔH=-Q2 kJ/mol。 则Q1 Q2
A. 大于 B. 小于 C. 等于 D. 无法比较
难度: 简单查看答案及解析
-
在一个固定体积的密闭容器中,放入3 L X(g)和3 L Y(g),在恒温恒体积下发生反应3X(g)+3Y(g)
2Q(g)+nR(g),达到平衡后,X的转化率为35%,混合气体的压强却比起始压强小,则方程中n的值是( )
A. 3 B. 4 C. 5 D. 6
难度: 简单查看答案及解析
-
真空密闭容器中盛有1 mol PCl5,加热到200℃,发生反应PCl5(g)
PCl3(g)+Cl2(g),反应达到平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入2 mol PCl5,反应达到平衡时,PCl5所占体积分数为N%,则M和N的正确关系是 ( )
A. M>N B. M<N
C. M=N D. 无法比较
难度: 简单查看答案及解析
-
在一密闭容器中发生反应:2A(g)+2B(g)
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
难度: 简单查看答案及解析
-
浓度均为0. 1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )
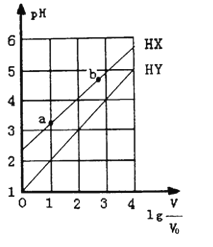
A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
难度: 中等查看答案及解析
-
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
A. 甲中水电离出来的H+的物质的量浓度是乙中水电离出来H+的物质的量浓度的10倍
B. 中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
C. 物质的量浓度c(甲)>10c(乙)
D. 甲中的c(OH-)为乙中的c(OH-)的10倍
难度: 中等查看答案及解析
-
浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )

A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
难度: 中等查看答案及解析
-
已知可逆反应aA+bB
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )

A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
难度: 中等查看答案及解析
-
在一密闭的容器中,将一定量的NH3加热使其发生分解反应:2NH3(g)
N2(g)+3H2(g),当达到平衡时,测得25%的NH3分解,此时容器内的压强是原来的( )
A. 1.125倍 B. 1.25倍
C. 1.375倍 D. 1.5倍
难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
难度: 中等查看答案及解析
-
一定条件下,往容积恒定的密闭容器中投入2molA和1molB,发生可逆反应:2A(g)+B(g)
C(g)+D(s),达到平衡时,测得压强为原压强的5/6,则A的转化率为 ( )
A. 25% B. 40% C. 50% D. 75%
难度: 中等查看答案及解析
-
一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥ B. ⑦④ C. ①③ D. ②⑧
难度: 中等查看答案及解析
-
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
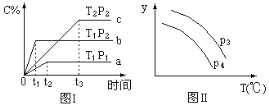
A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
②H2(g)+1/2O2(g)=H2O(g)△H2
③C(s)+O2(g)=CO2(g)△H3
④4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)△H4
下列说法不正确的是( )
A. △H4=12△H3+10△H2﹣2△H1
B. 若将①中 H2(g)改为 H2(l)则△H>△H1
C. C(金刚石,s)与 C(石墨,s)的燃烧热不同
D. △H2是 H2(g)的燃烧热
难度: 中等查看答案及解析
-
已知:△G=△H-T△S,当△G<0,反应能自发进行,△G>0反应不能自发进行。下列说法中正确的是( )
A. 非自发反应在任何条件下都不能发生
B. 熵增加且放热的反应一定是自发反应
C. 自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应
D. 凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol−1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol−1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol−1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol−1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
难度: 中等查看答案及解析