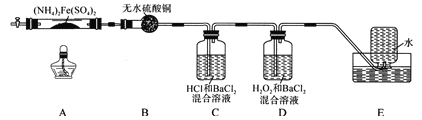
-
下列物质分类正确的是
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 福尔马林、水玻璃、氨水均为混合物
难度: 简单查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Cu2+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是
A. “另一种反应物”一定具有还原性
B. CuH既可做氧化剂也可做还原剂
C. CuH+Cl2=CuCl+HCl(燃烧)
D. CuH+HCl=CuCl+H2↑(常温)
难度: 困难查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应.
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 简单查看答案及解析
-
下表中所列出的物质,属于贴错包装标签的是( )
选项
A
B
C
D
物质的化学式
HNO3(浓)
CCl4
P4
KClO3
危险警告标志




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法或做法中正确的是
A. 试管可以做液体或溶液反应的实验,不能做固体反应的实验
B. 用蒸发皿小心蒸发碳酸氢钙溶液,最终得到碳酸氢钙晶体
C. 做氯气与钠反应的实验时,用玻璃燃烧匙或在普通燃烧匙中铺一层细沙
D. 熔融氢氧化钠固体,可用陶瓷坩埚
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列叙述正确的是
A. 1.0 L 1.0 mo1·L﹣1的NaAlO2 水溶液中含有的氧原子数为2 NA
B. 常温下,30 g SiO2晶体中含有Si﹣O键的数目为NA
C. 标准状况下,2.24 LCl2与足量水反应转移的电子数为0.2NA
D. V L a mol·L﹣1的氯化铁溶液中,若Fe3+的数目为NA,则Cl﹣的数目大于3NA
难度: 困难查看答案及解析
-
在透明的酸性溶液中,能大量共存的离子组是
A. Fe2+、Na+、Cl﹣、NO3﹣ B. Ba2+、Al3+、Cl﹣、NO3﹣
C. K+、Na+、HCO3﹣、Cl﹣ D. AlO2﹣、K+、OH﹣、Cl﹣
难度: 中等查看答案及解析
-
冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A. 1molCO2与SO3的混合气体氧原子数为2NA
B. 1mol/L KClO3溶液中含有NA个ClO3﹣
C. 标准状况下,11.2LCCl4所含的分子数为0.5NA
D. 25℃,1.01×105Pa,88gCO2中所含原子数为6NA
难度: 中等查看答案及解析
-
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ③转移溶液前容量瓶内有少量蒸馏水 ④定容时,俯视容量瓶的刻度线 ⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ①②⑤ B. ①③⑤ C. ③④⑤ D. ②③④
难度: 中等查看答案及解析
-
某同学向含有c(FeCl3)=0.2 mol·L-1、c(FeCl2)=0.1 mol·L-1的混合溶液中滴加稀NaOH溶液,意外地得到了一种黑色分散系,经查阅资料后得知,该分散系中分散质是直径介于1~100 nm之间的金属氧化物,下列有关说法错误的是
A. 该分散系可产生丁达尔现象
B. 加入NaOH时发生的反应可能为Fe2++2Fe3++8OH-===Fe3O4+4H2O
C. 若在电场作用下,阴极附近分散系黑色变深,则说明该分散质微粒带正电
D. 可用过滤的方法将分散剂与分散质分离开
难度: 中等查看答案及解析
-
(题文)欲配制250 mL 0.5 mol·L-1的NaOH溶液,在下列仪器中,需要用到的仪器按先后顺序排列正确的是
①量筒 ②250 mL容量瓶 ③托盘天平和砝码 ④500 mL容量瓶 ⑤烧杯 ⑥玻璃棒 ⑦漏斗 ⑧药匙 ⑨胶头滴管 ⑩250 mL的烧瓶
A. ③⑤⑧⑥②⑨ B. ②③⑦⑤⑥ C. ②⑤⑦⑥① D. ④③⑦⑤⑥
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 与铝反应产生大题氢气的溶液:NH4+、Na+、CO32﹣、NO3﹣
B. 能使硫氰化钾溶液显红色的溶液:K+、SO42﹣、S2﹣、SO32﹣
C. 常温下pH值为13的溶液中:K+、HCO3﹣、Na+、Cl﹣
D. 在使石蕊试液变红的溶液中:Na+、Cu2+、Br﹣、SO42﹣
难度: 中等查看答案及解析
-
某结晶水合物的化学式为R·nH2O,其相对分子质量为M.25℃时,ag该晶体能够溶于bg水中形成VmL溶液,下列关系中不正确的是
A. 该溶液中溶质的质量分数为ω=100a(M-18n)/(a+b)%
B. 该溶液的物质的量浓度为c=1000a/(MV)mol·L﹣1
C. 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=(18na/M+b):(a﹣18na/M)
D. 该溶液的密度为ρ=1000(a+b)/Vg·L﹣1
难度: 中等查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是
A. ClO2是还原产物
B. H2C2O4在反应中被氧化
C. 1molKClO3参加反应,转移电子物质的量为1mol
D. 生成5.6LCO2,转移的电子数目为0.25NA
难度: 中等查看答案及解析
-
离子方程式2Ca2+ + 3HCO3– + 3OH– == 2CaCO3↓ + CO32– + 3H2O可以表示
A. NH4HCO3与澄清石灰水反应 B. Mg(HCO3)2与澄清石灰水反应
C. Ca(HCO3)2与澄清石灰水反应 D. Ca(HCO3)2与NaOH溶液反应
难度: 中等查看答案及解析
-
检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是
A. NaOH B. KMnO4 C. KSCN D. 苯酚
难度: 中等查看答案及解析
-
下列关于Na2O2的叙述不正确的是( )
A.1 mol Na2O2与足量CO2反应转移的电子为1 mol
B.将10 g H2和CO的混合气体充分燃烧,将生成物(H2O、CO2)通入足量的Na2O2固体中充分反应,固体增重为10 g
C.将Na2O2投入FeSO4溶液中生成红褐色沉淀
D.将等物质的量的NaHCO3和Na2O2混合后,在密闭容器中充分加热排除气体后剩余固体为Na2CO3
难度: 简单查看答案及解析
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL的溶液含NaOH 1mol/L,然后滴加1mol/L的盐酸,测得生成沉淀的质量与消耗盐酸的体积关系如
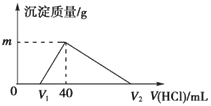
A. 原合金质量为0.92g B. 图中V2的值为60
C. 图中m的值为1.56 D. 产生氢气的体积为896mL(标准状况下)
难度: 困难查看答案及解析
-
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
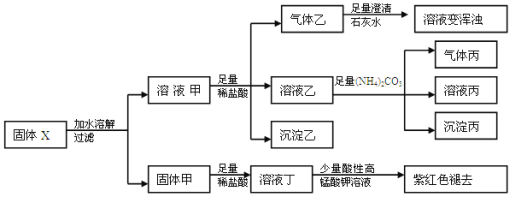
已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-下列说法正确的是( )
A. 气体乙和气体丙都为纯净物
B. 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 ,可能含有NaHCO3、Na2CO3
C. 溶液丁中的阳离子一定只含H+、Fe2+
D. 溶液甲中一定含有AlO2- ,可能含有CO32-
难度: 中等查看答案及解析
-
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示。原溶液中Cl-与SO42-的物质的量之比为

A. 1∶3 B. 2∶3 C. 3∶1 D. 6∶1
难度: 中等查看答案及解析
-
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+ 的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+ 物质的量分别为

A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
难度: 中等查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比为4:3:2,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
A. 1:1 B. 5:3 C. 5:2 D. 5:4
难度: 中等查看答案及解析