-
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用。下列做法与可持续发展宗旨相违背的是( )
A. 加大清洁能源的开发利用,提高资源的利用率
B. 推广碳捕集和储存技术,逐步实现二氧化碳零排放
C. 加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D. 对工业废水、生活污水净化处理,减少污染物的排放
难度: 简单查看答案及解析
-
已知氧化剂、稀酸等都能迅速破坏传染病毒活性而杀死病毒,下列物质不能作为常用消毒剂的是
A.H2O2溶液 B.NaClO溶液
C.SO2 D.醋酸
难度: 简单查看答案及解析
-
下列物质中不能用化合反应的方法制得的是( )
①SiO2 ②H2SiO3 ③Na2O2 ④Al(OH)3 ⑤FeCl3 ⑥CaSiO3
A. ①③⑤ B. ②④⑥ C. ②⑤ D. ②和④
难度: 中等查看答案及解析
-
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是:
A. 氧化剂 B. 还原剂 C. 催化剂 D. 载体
难度: 简单查看答案及解析
-
除去下列物质中所含的杂质。选用的试剂正确的是( )
选项
物质(杂质)
试剂
A
Al2O3(SiO2)
NaOH溶液
B
CO2(SO2)
Na2CO3溶液
C
FeCl2溶液(FeCl3)
Fe粉
D
NaHCO3溶液(Na2CO3)
Ca(OH)2溶液
难度: 中等查看答案及解析
-
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A. SO2和H2S B. Cl2 和CO2 C. NH3和CO2 D. SO2 和Cl2
难度: 中等查看答案及解析
-
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入氢氧化钠溶液,开始时有白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,下列结论中正确的是 ( )
A. 一定有Fe2+,一定没有Fe3+、Mg2+
B. 一定有Fe3+,一定没有Fe2+、Mg2+
C. 一定有Fe3+,可能有Fe2+,一定没有Mg2+
D. 一定有Fe2+,可能有Mg2+,一定没有Fe3+
难度: 中等查看答案及解析
-
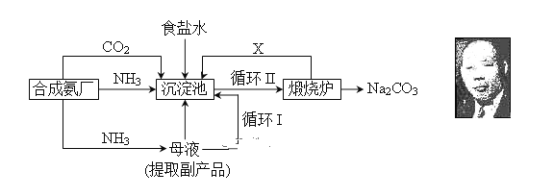
通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )

A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
难度: 困难查看答案及解析
-
用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
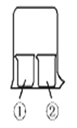
①中的物质
②中的物质
预测①中现象
A
淀粉碘化钾溶液
浓硝酸
无明显现象
B
酚酞溶液
浓盐酸
无明显现象
C
氯化铝溶液
浓氨水
有白色沉淀
D
湿润红纸条
饱和氯水
红纸条褪色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+= Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量NaOH溶液混合:HCO3-+Na++ OH-=CO32-+ H2O
C.将过量的SO2通入NaClO溶液中:SO2+ClO-+ H2O= HClO+HSO3-
D.将0.2mol•L-1KAl(SO4)2溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3 ↓+ 3BaSO4↓
难度: 困难查看答案及解析
-
下列对氯及其化合物的说法正确的是( )
A. 过量的铁在氯气中燃烧可生成氯化亚铁
B. 用pH试纸测得氯水的pH=4
C. 溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色
D. 由Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO可推出Ca(ClO)2+SO2+H2O===CaSO3↓+2HClO
难度: 中等查看答案及解析
-
溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示:
干海带
海带灰
水溶液
―→碘单质
下列有关叙述正确的是( )
A. 碘元素在海水中也有游离态存在 B. 在提取的过程中用的氧化剂可以是H2O2
C. 操作A是结晶或重结晶 D. B是提纯操作,常用蒸馏或分馏
难度: 中等查看答案及解析
-
对实验Ⅰ~Ⅳ的实验现象预测正确的是

A. 实验I:液体分层,下层呈无色
B. 实验II:烧杯中先出现白色沉淀,后溶解
C. 实验III:试管中溶液颜色变为红色
D. 实验IV:放置一段时间后,饱和硫酸铜溶液中出现蓝色晶体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 在粗硅的制取中发生2C+SiO2
2CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2
Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
难度: 中等查看答案及解析
-
某溶液中可能含有SO42-、 CO32-、Cl-、SO32-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )。
A. H2SO4 B. HCl C. NaOH D. HNO3
难度: 中等查看答案及解析
-
下列化学实验中,能证明某种中学常见气体为SO2的是( )。
①能使澄清的石灰水变浑浊;②能使湿润的蓝色石蕊试纸变红;③既能使品红溶液褪色又能使澄清的石灰水变浑浊;④将其通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸;⑤通入溴水,能使溴水褪色,再滴加Ba(NO3)2溶液,有白色沉淀。
A. 都能证明 B. 都不能证明 C. ③⑤能证明 D. 只有⑤能证明
难度: 中等查看答案及解析
-
有关实验的说法中正确的是( )
A. 除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤
B. 不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液
C. 制备Fe(OH)3胶体时,通常是将Fe(OH)3固体溶于沸水中
D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32-
难度: 中等查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是
A.
、Ba2+、
、
B. K+、
、
、
C. Ca2+、Mg2+、
、
D. Na+、
、
、
难度: 困难查看答案及解析
-
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是

A. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
B. V1∶V2=1∶5
C. M点时生成的CO2为0.05 mol
D. a曲线表示的离子方程式为:AlO2-+H++H2O===Al(OH)3↓
难度: 简单查看答案及解析
-
向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( )
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
难度: 中等查看答案及解析