-
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是

难度: 简单查看答案及解析
-
已知一些金属单质的发现与其金属活动性存在着某种必然的联系,你认为下列事件发生在铁器时代之前的是:①金属铝的冶炼;②青铜器时代;③金银的使用;④戴维发现金属钠;⑤15世纪中国使用锌铸币
A.②③⑤ B.②③ C.①②③ D.①④⑤
难度: 简单查看答案及解析
-
地壳中含量第一和第二的两种元素形成的化合物,不具有的性质是
A.熔点很高 B.与水反应生成对应的酸
C.可与生石灰反应 D.与碳在高温下反应可制取两元素中的一种单质
难度: 简单查看答案及解析
-
区别SO2和CO2气体可选用
A.通入澄清石灰水中 B.通入品红溶液中
C.用带火星的木条检验 D.通入石蕊试液中
难度: 简单查看答案及解析
-
下列实验能达到预期目的的是
A.检验溶液中是否含有
:滴加稀盐酸,将产生的气体通入澄清石灰水
B.从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取
C.检验溶液中是否含有
:先滴加稀硝酸,再滴加BaCl2溶液
D.分离NaCl和NH4Cl:将固体加热
难度: 简单查看答案及解析
-
下列说法中正确的是
A.氮元素是活泼的非金属元素,因此N2的化学性质也很活泼
B.NO2溶于水生成硝酸,因此NO2是硝酸的酸酐
C.雷雨时,可增加土壤中硝酸盐类氮肥的含量,此变化属于氮的固定
D.氮气不能做焊接金属时的保护气
难度: 简单查看答案及解析
-
下列物质中可用来干燥NH3的是
A.浓H2SO4 B.碱石灰 C.P2O5 D.无水CaCl2
难度: 简单查看答案及解析
-
现有下列物质,其中必须保存在棕色瓶里的是:①氯水;②氨水;③浓硝酸;④硝酸银;⑤烧碱
A.①②③ B.①③④ C.①③ D.②⑤
难度: 简单查看答案及解析
-
下列关于浓硝酸和浓硫酸的叙述,正确的是
A.常温下都用铜容器贮存 B.露置在空气中,容器内酸液的质量都减轻
C.常温下都能与铜较快反应 D.露置在空气中,容器内酸液的浓度都降低
难度: 简单查看答案及解析
-
用下列实验装置进行的实验,能达到相应实验目的的是
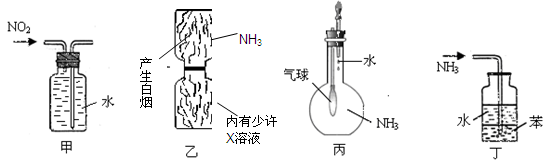
A.装置甲:收集NO2气体 B.装置乙:验证X溶液为浓硫酸
C.装置丙:验证氨气的水溶性 D.装置丁:用于吸收尾气NH3
难度: 简单查看答案及解析
-
人体血红蛋白中含有Fe2+离子,误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
难度: 简单查看答案及解析
-
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、c、e均能与稀硫酸反应放出气体;②b与d的硝酸盐反应,置换出单质d;③c与强碱反应放出气体;④c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次为
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
难度: 简单查看答案及解析
-
将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是
A.硫酸 B.氯水 C.硝酸锌 D.溴水
难度: 简单查看答案及解析
-
对于化学方程式SiO2+3CSiC+2CO↑,有关叙述正确的是
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C既是氧化剂又是还原剂
D.在反应中氧化剂与还原剂的物质的量之比为1∶1
难度: 简单查看答案及解析
-
下列各组物质中,满足下图物质一步转化关系的选项是

难度: 简单查看答案及解析
-
下列各组离子,在强碱性溶液中可以大量共存的是
A.K+、Na+、H+、C1- B.Na+、Ba2+、Mg2+、NO3-
C.NH4+、K+、Cl-、NO3- D.K+、Na+、CO32-、S2-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO===BaSO4↓+H2O
B.过量的SO2通入NaOH溶液中:SO2+2OH-===SO+H2O
C.铜在加热条件下与浓硫酸反应:Cu+SO+4H+===Cu2++SO2↑+2H2O
D.SO2使溴水褪色:SO2+Br2+2H2O===SO+2Br-+4H+
难度: 简单查看答案及解析
-
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
难度: 简单查看答案及解析
-
0.3 mol Cu与足量的稀HNO3完全反应时,被还原的HNO3的物质的量是
A.0.3 mol B.0.6 mol C.0.4 mol D.0.2 mol
难度: 简单查看答案及解析
-
3.2g铜与过量硝酸(8mol·L-1,30mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量是
A.0.2+a B.0.1+a C.0.05+a D.a
难度: 简单查看答案及解析