-
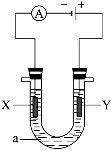
在原电池的电极上所发生的反应,下列说法正确的是
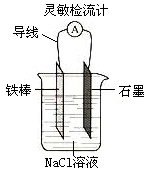
A.原电池的正极发生氧化反应
B.原电池的负极发生氧化反应
C.发生原电池反应时,溶液中的阳离子向负极定向移动
D.如上图,可观察到灵敏检流计的指针不偏转;
难度: 中等查看答案及解析
-
串联电路中四个电解池分别装有0. 5 mol/L的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是
A.KNO3溶液 B.NaCl溶液 C.AgNO3溶液 D.CuCl2溶液
难度: 中等查看答案及解析
-
在铁制品上镀上一定厚度的铜层,以下设计方案正确的是
A.铜作阳极,镀件作阴极,溶液中含有铜离子
B.铁作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜用阴极,镀件作阳极,溶液中含有锌离子
难度: 困难查看答案及解析
-
能说明醋酸是弱电解质的是:
①PH=2的醋酸溶液稀释至体积为原来的100倍后PH<4
②稀的醋酸溶液中加入少量的醋酸铵固体,溶液的酸性减弱(醋酸铵溶于水显中性)
③可以用食醋清除热水瓶内的水垢
A.①③ B.①② C.②③ D.全部
难度: 中等查看答案及解析
-
下列说法正确的是
A.所有自发进行的化学反应都是放热反应
B.放热反应一定比吸热反应的反应速率快
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应过程
D.反应速率快的反应,其反应物的转化率一定高
难度: 中等查看答案及解析
-
下列关于强、弱电解质的叙述中正确的是
A.只有强酸和强碱是强电解质,只有弱酸和弱碱是弱电解质
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.易溶于水的强电解质水溶液中无溶质分子,易溶的弱电解质水溶液中有溶质分子
D.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(g)
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1
B.v(C)=1.6mol·L-1·min-1
C.v(D)=0.4 mol·L-1·min-1
D.v(B)=1.8mol·L-1·min-1
难度: 中等查看答案及解析
-
下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO
2Hg + O2↑
B.2A12O3
4Al+3O2↑
C.H2 + Na2O
2Na + H2O
D.4 CO + Fe3O4
3Fe + 4CO2
难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.不用铁片,改用铁粉
C.滴加少量CuSO4溶液 D.不用稀硫酸,改用浓硝酸
难度: 中等查看答案及解析
-
在一定温度下,可逆反应A(g) + 3B(g)
2C(g)达到平衡的标志是
A、单位时间内生成n mol A,同时生成2n mol C
B、A、B、C的浓度相等
C、单位时间内生成n mol A,同时生成3n mol B
D、A、B、C的分子数之比为1:3:2
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.反应NH3(g)+HCl(g)
NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B.稀氨水中加入氢氧化化钠固体少量,由于氨水的电离平衡逆向移动,所以溶液的碱性减弱
C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
D.CH3COOH溶液加水稀释后,溶液中
的值减小
难度: 困难查看答案及解析
-
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2=2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发,下列叙述正确的是
A.此电池工作时会发出蓝色火焰
B.燃料电池具有能量转化率高、可持续使用的优点
C.该电池的负极电极反应式为:2H2+4e-=4H+;
D.该电池的正极电极反应式为:O2+2H2O+4e -=4OH-
难度: 困难查看答案及解析
-
恒温恒容的密闭容器中盛有2mol SO3,发生反应2SO3(g)
2SO2(g)+O2(g),一定条件下平衡时SO2所占的体积百分数为M,若相同条件相同容器中,最初放入4 mol SO3,则平衡时,SO2的体积百分数为N,下列结论正确的是
A.M=N B.M>N C.M<N D.无法比较
难度: 中等查看答案及解析
-
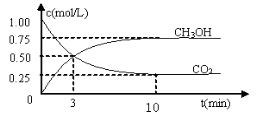
用来表示可逆反应2A(g) + B(g)
2C(g) ;△H<0的正确图像为
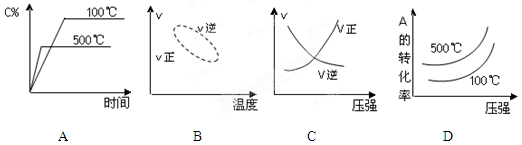
难度: 中等查看答案及解析
-
恒温恒容时,向体积为2.0L密闭容器中充入1.0 molPCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/ mol
0
0.16
0.19
0.20
0.20
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0016 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.12 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
难度: 极难查看答案及解析