-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3•H2O)
B. 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
难度: 中等查看答案及解析
-
下列说法正确的是
A. 反应物的热效应与是否使用催化剂无关
B. 4NO2(g)+O2(g)=2N2O5 (g)的过程属于熵增加过程
C. 由C(石墨)= C(金刚石)△H﹥0,可知金刚石比石墨稳定
D. 对任何化学反应来说,反应速率越大,反应现象就越明显
难度: 简单查看答案及解析
-
化学是一门实用性很强的科学,与社会、环境、生活等密切相关。下列说法正确的是
A. 明矾净水与自来水的杀菌消毒原理是一样的
B. 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
C. 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
D. 糖类、油脂、蛋白质都是高分子化合物,它们都能发生水解反应
难度: 简单查看答案及解析
-
下列食用品的有效成分正确的是
A.
 C6H12O6 B.
C6H12O6 B.  Na2CO3
Na2CO3C.
 CH3COOH D.
CH3COOH D.  Al(OH)3
Al(OH)3难度: 简单查看答案及解析
-
化学中有许多的 “守恒或相等”,下列说法中不满足守恒或相等的是
A. 化学反应中,参加反应物总质量与生成物总质量
B. 化学反应中,反应物总能量与生成物总能量
C. 溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数
D. 溶液中,稀释前溶质质量与稀释后溶质质量
难度: 简单查看答案及解析
-
下列关于有机物说法不正确的是:
A.
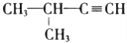 命名为3-甲基-1-丁炔
命名为3-甲基-1-丁炔B. 沸点比较:乙醇>丙烷>乙烷
C.
属于芳香烃且属于苯的同系物
D. 含5个碳原子的有机物,每个分子中最多可形成4个C-C单键
难度: 中等查看答案及解析
-
下列化合物中,既能发生水解反应,又能发生消去反应,且消去反应生成的烯烃只有一种的是
A. CH3Cl B.
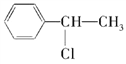 C.
C. 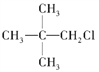 D.
D. 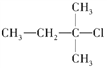
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol1
C. 密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H= —38.6kJ·mol1
难度: 中等查看答案及解析
-
常温下,下列各组离子可能大量共存的是
A. pH=1的溶液中:K+、Cu2+、Cl、CO32
B. 0.1mol/L FeCl3溶液中:Al3+、SO42、I、SCN
C. 使pH 试纸变红的溶液中:Fe2+、Mg2+、NO3、Cl
D. 由水电离产生的c(H+)=1×1013mol/L的溶液中:Cl、NO3、Ba2+、Na+
难度: 中等查看答案及解析
-
下列溶液,其电离方程式不正确的是
A. NH3•H2O = NH4+ + OH B. NaOH = Na+ + OH
C. CH3COOH
CH3COO + H+ D. NaHSO4 = Na+ + H++SO42
难度: 简单查看答案及解析
-
某校学生配置标准浓度的NaOH溶液来测定未知浓度的盐酸溶液,下列有关操作和说法正确的是
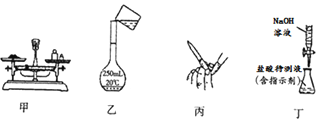
A. 用图甲所示装置准确称得2.21g NaOH固体
B. 用图乙所示操作转移NaOH溶液到容量瓶中
C. 用图丙所示操作排除碱式滴定管中的气泡
D. 用图丁所示装置以NaOH标准液滴定未知浓度盐酸溶液
难度: 中等查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH)的操作是
(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中加入明矾晶体 (5) 向水中加入NaHCO3固体 (6) 向水中加KHSO4固体
A. (4) B. (1) (4) (6) C. (1) (3) (6) D. (4) (6)
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应X(g) + Y(g)
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表,下列说法正确的是
t /min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A. 反应前2min的平均速率υ(Z) = 2.0×103mol/(L•min)
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆) < υ(正)
C. 该温度下此反应的平衡常数K=120
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 中等查看答案及解析
-
下列图示与对应的叙述符合的是
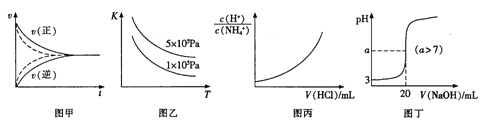
A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
难度: 困难查看答案及解析
-
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )
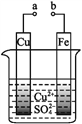
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-
Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
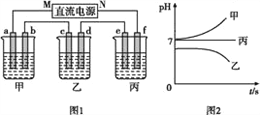
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是
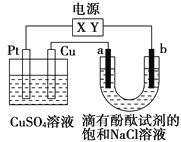
A. X极是电源负极,Y极是电源正极
B. 电解过程中CuSO4溶液的pH逐渐增大
C. a极的电极反应是2Cl--2e-=Cl2↑
D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
难度: 中等查看答案及解析
 和
和 两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)