-
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为( )
A. 1:2:3 B. 1:6:9 C. 1:3:3 D. 1:3:6
难度: 中等查看答案及解析
-
在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0. lmol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为
A. 0.15mol/L B. 0.45mol/L C. 0.6mol/L D. 0.3mol/L
难度: 中等查看答案及解析
-
氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是 ( )
A. 汉弗莱·戴维 B. 舍勒 C. 阿伏加德罗 D. 侯德榜
难度: 中等查看答案及解析
-
发现原子中存在电子的科学家是
A. 英国科学家道尔顿 B. 英国科学家汤姆生
C. 英国科学家卢瑟福 D. 丹麦物理学家玻尔
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A. 纯碱的化学式为NaHCO3 B. 氧离子结构示意图:
C. 碳酸氢钠的电离方程式 NaHCO3═Na++HCO3- D. 质量数为37的氯核素符号:
Cl
难度: 中等查看答案及解析
-
在容量瓶上无须标记的是
A. 标线 B. 温度 C. 浓度 D. 容量
难度: 简单查看答案及解析
-
关于100ml1mol/LCaCl2溶液的叙述正确的是
A. Cl-的物质的量浓度为2mol/L
B. CaCl2的物质的量为1mol
C. 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L
D. 该溶液中水的体积为100 mL
难度: 中等查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如图所示,有1、2、3、4四个区域。则下列化学反应属于区城1的是( )

A. Cl2+2KBr=Br2+2KCl B. 2NaHCO3
Na2CO3+H2O+CO2↑
C. 4Fe(OH)2+O2+2H2O=4Fe(OH)3 D. CH4+2O2
CO2+2H2O
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 25℃,1.01×105 Pa, 44g CO2中含有的原子数为3NA
C. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
D. 标准状况下,11.2LH2O 含有的分子数为0.5NA
难度: 简单查看答案及解析
-
铋(Bi)在医药方面有重要应用。下列关于
Bi和
Bi的说法正确的是( )
A. 两者都含有83个中子 B. 两者互为同位素
C. 两者的核外电子数不同 D. 两者分别含有126和127个质子
难度: 中等查看答案及解析
-
下列电离方程式书写正确的是( )
A. KClO3═K++Cl5﹣+3O2﹣ B. HNO3═H++NO3﹣
C. Na2CO3═Na2++CO32﹣ D. CaCl2═Ca2++Cl﹣
难度: 中等查看答案及解析
-
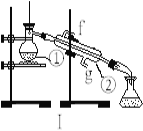
做焰色反应实验用的铂丝,每试验一种样品后都必须进行的操作是( )
A. 用水洗涤2~3次后再使用
B. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
C. 用滤纸擦干后才可使用
D. 用盐酸洗涤后,经蒸馏水冲洗,方可使用
难度: 中等查看答案及解析
-
溶液、胶体和浊液这三种分散系的根本区别是 ( )
A. 是否大量分子或离子的集合体 B. 分散质粒子直径的大小
C. 是否能通过滤纸或半透膜 D. 是否均一、稳定、透明
难度: 中等查看答案及解析
-
在下列变化中,需要加入合适的氧化剂才能实现的是
A. KMnO4→O2 B. CO 2→CO C. Fe2O3→Fe D. Br→Br2
难度: 中等查看答案及解析
-
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A. 将Na2CO3固体加入新制的氯水中,有无色气泡(H+)
B. 向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2)
C. 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D. 新制氯水使红色布条褪色(HCl)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 漂白粉有效成分是氯酸钙
B. 液氯是纯净物,而氯水是混合物
C. 碘化钾水溶液能使淀粉变蓝
D. 氯气通入水中能置换出氢气
难度: 简单查看答案及解析
-
钠与水反应时可能产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成闪亮的小球;④小球迅速四处游动,发出嘶嘶的声音;⑤小球逐渐减小,最后消失;⑥滴入酚酞后溶液显红色。其中完整的正确的组合是:( )
A. ①③④⑤⑥ B. ②③④⑤⑥ C. ①③④⑤ D. 全部
难度: 中等查看答案及解析
-
下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A. 相同浓度溶液的碱性:Na2CO3>NaHCO3
B. 在水中的溶解度:Na2CO3>NaHCO3
C. 与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D. 热稳定性:NaHCO3<Na2CO3
难度: 中等查看答案及解析
-
下列有关用途叙述错误的是( )
A. 碘化银为黄色固体,可用作人工降雨
B. 钠钾合金常温下为液体,可做快中子反应堆的导热剂
C. 钠还原性强,可从氯化物溶液中置换出钛钽铌锆等金属
D. 热的碳酸钠溶液可去除油污,碳酸氢钠常用于中和胃酸
难度: 中等查看答案及解析
-
室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是
A. NH4+、Cu2+、 Cl-、NO3- B. K+、Na+、CO32-、S2-
C. K+、Na+、 CH3COO-、SO42- D. Ba2+、Mg2+、HCO3-、Cl-
难度: 中等查看答案及解析
-
将下列离子方程式改写成化学方程式,正确的是( )
A. Cu2++2OH-===Cu(OH)2↓ CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B. CO
+2H+===H2O+CO2↑ BaCO3+2HCl===BaCl2+H2O+CO2↑
C. Ca2++CO
===CaCO3↓ Ca(OH)2+BaCO3===CaCO3↓+Ba(OH)2
D. H++OH-===H2O 2KOH+H2SO4===K2SO4+2H2O
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A. 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
C. 铜片插入硝酸银溶液中:Cu + 2Ag+ === Cu2+ + 2Ag
D. 澄清石灰水中加入盐酸 Ca(OH)2+2H+ = Ca2++2H2O
难度: 简单查看答案及解析
-
已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣=2RO4n-+3Cl﹣+5H2O,则RO4n-中R的化合价是( )
A. +3 B. +4 C. +5 D. +6
难度: 中等查看答案及解析
-
将4gNaOH和10.6gNa2CO3混合并配成溶液,向溶液中滴加0.1mol﹒L﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
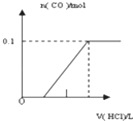 B.
B. 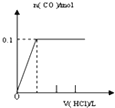
C.
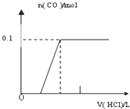 D.
D. 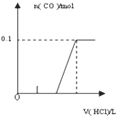
难度: 中等查看答案及解析