-
为减轻环境污染,北京为汽车加装了“三元催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒的混合气体,该混合气体是
A.二氧化碳和氮气 B.二氧化碳和二氧化氮
C.二氧化碳和氧气 D.二氧化碳和氧化二氮
难度: 简单查看答案及解析
-
日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述不正确的是( )
A.用食醋清洗热水瓶中的水垢
B.用纯碱溶液洗涤餐具上的油污
C.用米汤检验含碘盐中的碘酸钾
D.利用丁达尔效应区别蛋白质溶液和食盐水
难度: 简单查看答案及解析
-
“酸化”是实验中经常采用的方法,下列说法正确的是( )
A.提高高锰酸钾的氧化能力,用浓盐酸酸化
B.抑制Fe2+ 的水解,用稀硝酸酸化
C.检验某水溶液中是否含Cl-离子,先加HNO3溶液酸化,再加AgNO3检验
D.确认溶液中含有SO42-时,用盐酸和BaCl2的混合溶液来检验
难度: 简单查看答案及解析
-
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
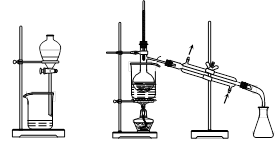
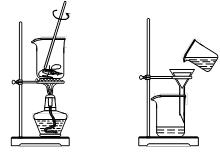
A.放出碘的苯溶液 B.分离碘并回收苯 C.将海带灼烧成灰 D.过滤得含I-溶液
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.0.1molNa2O2中含有的离子数为0.4NA
B.利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA
C.7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA
D.标准状况下,
和
混合气体中含有的原子数是
难度: 简单查看答案及解析
-
某溶液大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,物质的量之比为:n(NO3-):n(SO42-) :n(Fe3+) :n(H+) :n (X) = 2 :3 :1 :3 :1,则X 可能为( )
A.Fe2+ B. Mg2+ C.Cl- D.Ba2+
难度: 简单查看答案及解析
-
将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中
固体X、液体Y及检测方法对应关系错误的是 ( )
选项
固体X
液体Y
检测方法
A
CaO
浓氨水
蘸有浓盐酸的玻璃棒
B
Cu
浓硫酸
干燥的红色石蕊试纸
C
Na2O2
水
带火星的木条
D
Na2CO3
稀硫酸
滴有澄清石灰水的玻璃片
难度: 简单查看答案及解析
-
欲使NaCl、NH4Cl和SiO2的混合物分开,其必要的操作为
A.升华、溶解、过滤、蒸发 B.溶解、过滤、蒸发、分液
C.加热、溶解、过滤、结晶 D.溶解、过滤、分馏、结晶
难度: 简单查看答案及解析
-
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶中气体是( )

① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②④ C.③④ D.②③
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.金属钠投入水中: Na + H2O
Na+ + OH- + H2↑
B.铜加入稀硝酸中: 3Cu + 8H+ + 2NO3-
3Cu2+ + 2NO↑+ 4H2O
C.向AlCl3溶液中加入过量氨水: Al3+ + 4NH3• H2O
AlO2-+ 4NH4+ + 2H2O
D NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH-
NH3↑+ H2O
难度: 简单查看答案及解析
-
铜粉放入稀硫酸中,加热后无明显现象发生,当加入下列一种物质后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该物质是
A、Fe2(SO4)3 B、Na2CO3 C、KNO3 D、FeSO4
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
A.①④⑤ B.①⑤⑥ C.②③④ D.④⑤⑥
难度: 简单查看答案及解析
-
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是
序号
物 质
杂质
除杂质应选用的试剂或操作方法
①
KNO3溶液
KOH
滴入稀盐酸,同时用pH计测定至溶液呈中性
②
FeSO4溶液
CuSO4
加入过量铁粉并过滤
③
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④
Na2SO4
CaCO3
溶解、过滤、蒸发、结晶
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 简单查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为3Fe2+ + 2S2O32-+ O2 + aOH-== Y+S4O62-+2H2O,下列说法中,不正确的是
A.a=4 B.Y的化学式为Fe2O3
C.S2O32-是还原剂 D.每有1 mol O2参加反应,转移的电子总数为4 mol
难度: 简单查看答案及解析
-
下列各组溶液中,不用任何其他试剂就能鉴别的是
A.Na2SO4 H2SO4 AlCl3 BaCl2
B.HCl NaOH K2SO4 NaHCO3
C.NaAlO2 KNO3 NaCl NaHSO4
D.NaOH FeCl3 MgCl2 K2SO4
难度: 简单查看答案及解析
-
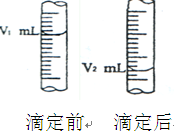
300 mL 2 mol·L
硝酸与一定量的铝镁铁合金反应生成 3.36 L NO (标准状况)
和铁盐、铝盐、镁盐等,再向反应后的溶液中加入 3 mol·L
的NaOH 溶液,使铝镁铁
元素恰好全部转化为沉淀,则所加NaOH 溶液的体积是 ( )
A. 150 mL B. 200 mL C. 450 mL D.无法计算
难度: 简单查看答案及解析
-
为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是 ( )
①分别取样加入1mol/L的盐酸溶液,看有无气泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
A.①③⑤ B.②④ C.①⑤ D.③
难度: 简单查看答案及解析
-
X、Y、Z、W有如右图所示的转化关系,则X、Y可能是
① C、CO ② AlCl3 、Al(OH)3
③ Fe、Fe(NO3)2 ④ Na2CO3 、NaHCO3
A.①②③ B.①② C.③④ D.①②③④
难度: 简单查看答案及解析