-
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性.下列有关分析正确的是( )
A.K3C60中只有离子键
B.K3C60中不含共价键
C.该晶体在熔融状态下能导电
D.C60与12C互为同素异形体难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO-4、SO2-4
②pH=11的溶液中:CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中:Cl-、HCO-3、SO2-4、NH+4
④由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br一
⑤有较多Fe3+的溶液中:Na+、H+、SCN-、HCO-3
⑥酸性溶液中:Fe2+、Al3+、NO-3、I-、Cl-.
A.①②
B.③⑥
C.②④
D.⑤⑥难度: 中等查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe.有关该电池的下列说法中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+Fe-2e-=2Li++FeS难度: 中等查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与 F同主族,E与F同周期.已知常温下单质A与E的状态:不同,D原子的核电荷 数是B原子最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
A.由A、C、D三种元素组成的化合物一定是共价化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.元素的非金属性由强到弱的顺序是:D>C>F>B难度: 中等查看答案及解析
-
下列实验操作正确的是( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②将0.1mol/L的氢氧化钠溶液与0.5mol/L的硫酸铜溶液等体积混合制得氢氧化铜浊液,用于检验醛基
③可用氯化铁溶液除去试管内难以刷去的铜迹
④欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑤分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出.
A.①④
B.②⑤
C.③⑤
D.②③④⑤难度: 中等查看答案及解析
-
定条件下,存在可逆反应X(g)+2Y(g)
3Z(g),若X、Y、Z起始浓度分别为c1,c2,c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是( )
A.c1:c2=l:2
B.达平衡状态时,生成Z的速率是生成X速率的3倍
C.X、Y的转化率不相等
D.C2的取值范围为0<c2<0.24难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.5.6g铁粉在2.24L(标准状态)氯气中充分燃烧,失去的电子数为0.3NA
B.常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1 NA
C.在标准状况下,22.4LHF与18gH2O所含有的电子数均为10 NA
D.用2mol铜与含硫酸为4 mol的浓硫酸完全反应,转移的电子数为4 NA难度: 中等查看答案及解析
-
下列实验装置、试剂选用或操作正确的是b( )
A.
除去NO中的NO2
B.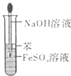
制取Fe(OH)2
C.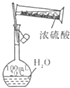
配置一定物质的量浓度硫酸
D.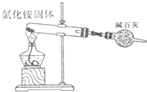
氨气的制取难度: 中等查看答案及解析
-
下列各组物质中,气体X和气体Y同时通入盛有溶液z的洗气瓶中(如图),一定没有沉淀生成的( )
X Y Z A NO2 SO2 BaCl2 B NH3 CO2 Al(SO4)3 C NH3 CO2 CaCl2 D CO2 SO2 CaCl2 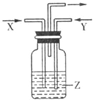
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
相同温度度,体积均为0.25L的两个恒容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g)△H=-92.6kJ•mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是( )
容器编号 起始时各物质物质的量/mol 达平衡时体系能量的变化 X2 Y2 XY3 ① 1 3 放热46.3kJ ② 0.8 2.4 0.4 Q(Q>0)
A.容器①、②中反应的平衡常数相等
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1
D.若容器①体积为0.20L.则达平衡时放出的热量大于46.3kJ难度: 中等查看答案及解析
-
已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出蓝色的字“神奇的化学”,据此判断下列说法正确的是( )
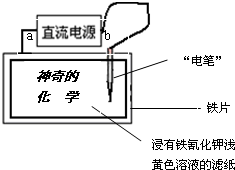
A.直流电源的a极是阴极
B.直流电源的b极是负极
C.阳极反应为:[Fe(CN)6]3-+e-═Fe2++6CN-
D.“电笔”笔尖材料是铁,其电极反应为:Fe-2e-═Fe2+难度: 中等查看答案及解析
-
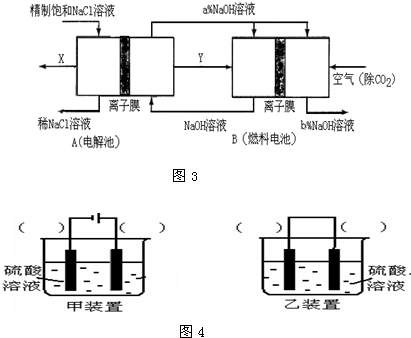
下列装置或操作不能达到实验目的是(双选 )( )
A.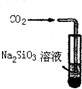
比较H2CO3和H2SiO3酸性强弱
B.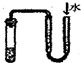
检查装置的气密性
C.
电解制Cl2和H2
D.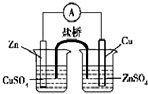
构成锌铜原电池难度: 中等查看答案及解析
-
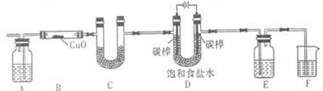
以下是几种常见的制气装置,其中可用于制取乙炔的是( )
A.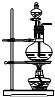
B.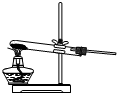
C.
D.难度: 中等查看答案及解析
-
用于净化汽车尾气的反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059.下列说法正确的是( )
A.装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570K时该反应正向进行的程度很大,故使用催化剂并无实际意义难度: 中等查看答案及解析
-
有关常温下pH均为11的氨水和氢氧化钡溶液的说法正确的是( )
A.两种溶液中,由水电离出的氢氧根离子浓度均为1×10-11 mol•L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.氨水中的c(NH4+)和氢氧化钡中的c(Ba2+):后者是前者的两倍
D.用等浓度盐酸分别中和体积相等的两种溶液,消耗盐酸的体积相同难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )
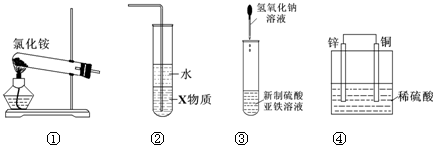
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是原电池,锌电极为负极,发生还原反应难度: 中等查看答案及解析
-
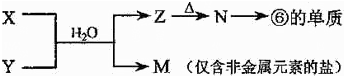
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系:A在碱性条件下反应生成B、C,B、C在酸性条件下生成A(部分产物及反应条件已略去).下列判断正确的是( )
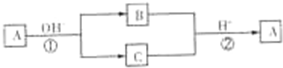
A.反应①和②一定为氧化还原反应
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.X元素可能为Al难度: 中等查看答案及解析