-
生活中的某些问题,常涉及到化学知识,下列分析不正确的是( )
A.冰箱中使用的含氟制冷剂泄漏后,会破坏臭氧层
B.Cl2和SO2都有漂白作用,都可以使有色棉布褪色
C.减少硫的氧化物和氮氧化物向空气中的排放,是防止酸雨形成的有效措施
D.严格地讲实验室使用排风扇是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收
难度: 中等查看答案及解析
-
下列操作会导致实验结果偏高的是 ( )
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.定容后反复摇匀发现液面低于刻度,没有再加水,所得溶液的浓度
C.配制一定物质的量浓度的溶液时,用量筒量取浓溶液的体积时仰视读数,所得溶液的浓度
D.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
难度: 中等查看答案及解析
-
对于氯化铁溶液和氢氧化铁胶体,以下说法正确的是 ( )
A.分散质粒子直径都在1nm~100nm之间
B.分散质微粒都能透过半透膜
C.加热蒸干并灼烧后都有氧化铁生成
D.分散系中分散质微粒前者带电荷、后者不带电荷
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是 ( )
A.25℃时,1 L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
B.1L 1 mol·L-1的盐酸中,所含氯化氢分子数为6.02×1023
C.1 mol羟基(-OH)所含的电子数约为10×6.02×1023
D.标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于6.02×1023
难度: 中等查看答案及解析
-
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2 = LiNH2+ LiH下列说法正确的是 ( )
A.亚氨基锂(Li2NH)中N的化合价为-1
B.此法储氢和钢瓶储氢的原理相同
C.Li+ 和H— 的半径相同
D.该反应中氢气既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作可能使测定结果偏低的是 ( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2—3次
难度: 中等查看答案及解析
-
今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是 ( )
A.若a=b,且
,则相同条件时,酸性
B.若a=b,且
,则相同条件时,酸性
C.若a>b,且
,则相同条件时,酸性HX<HY
D.若等体积混合,且
,则一定有
难度: 中等查看答案及解析
-
某溶液中存在XO3―,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )
A.Na+ H+ SO42― I― B.Na+ Ca2+ CO32― Al3+
C.Na+ K+ Fe2+ H+ D.K+ SO42― Cl― CO32―
难度: 中等查看答案及解析
-
“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是 ( )
A.2Na + 2H2O=2NaOH + H2↑是酸碱反应
B.ClO-+ H2O
HClO + OH-是酸碱反应
C.碱性强弱顺序:ClO—>OH—>CHCOO—
D.HCO3-既是酸又是碱,NH3既不是酸又不是碱
难度: 中等查看答案及解析
-
下列方程式书写正确的是( )
A.等物质的量的Ba(OH)2与KAl(SO4)2溶液混合的离子方程式:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.NaHCO3水解的离子方程式:HCO3-+ H2O
CO32-+H3O+
C.K37ClO3 与浓盐酸反应制氯气的化学方程式:
K37ClO3 + 6HCl (浓)
K37Cl + 3Cl2↑+ 3H2O
D.表示乙醇燃烧热的热化学方程式(△H的绝对值正确):
;
难度: 中等查看答案及解析
-
X、Y、Z和R为原子序数依次递增的四种元素。其中X、Y同周期,X的最高正价是最低负价绝对值的3倍,Y、Z、R同主族,R为人体所需的微量元素。下列说法不正确的是 ( )
A.127R—的核外含有54个电子
B.Y、Z、R的氢化物对应酸的酸性逐渐增强
C.有l molY的单质与水发生反应则转移电子的物质的量为2 mol
D.在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色
难度: 中等查看答案及解析
-
固体NH4I放入一个体积为V L的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)
NH3(g)+HI(g);2HI(g)
H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是 ( )
A.平衡时氨气为2.5 mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变,把容器的体积缩小到L,重新达平衡时H2的浓度是原平衡的2倍
难度: 中等查看答案及解析
-
将0.1mol·L—1的某二元弱酸(H2X)溶液和0.1mol·L—1 NaOH溶液等体积混合后(忽略混合前后溶液体积变化),下列关系式中错误的是 ( )
A.c(HX—)+c(X2—)+c(H2X)=0.05mol·L—1
B.c(HX—)<c(X2—)
C.c(Na+)>c(HX—)
D.c(H+)+c(Na+)=c(OH—)+c(HX—)+2c(X2—)
难度: 中等查看答案及解析
-
一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01mol/L的NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为( )
A.2:3 B.1:3 C.1:4 D.5:3
难度: 中等查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是
c(Na+) >c(S2-) >c(OH-) >c(HS-) >c(H+)
C.pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+ c(HR-)=c(Na+)
D.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
难度: 中等查看答案及解析
-
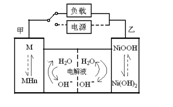
下列关于各图的说法,正确的是 ( )

A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
难度: 中等查看答案及解析
-
已知可逆反应2NO2(g)
N2O4(g);△H<0,在一定条件下,反应达到平衡后,改变下列条件,再次达到平衡后,容器中气体颜色加深的是( )
①减小容器体积 ②升高温度
③定容下充入NO2气体 ④定压下充入NO2气体
A.①②③④ B.①②③ C.①② D.①③
难度: 中等查看答案及解析
-
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
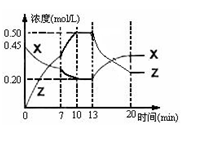
A.用X表示0~10min内该反应的平均速率为0.025 mol/(L·min)
B.根据上图可求得方程式中a:b=2:1
C.0~10min 容器内气体的压强逐渐增小
D.第13min时曲线变化的原因可能是增加了Z的量
难度: 中等查看答案及解析
-
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
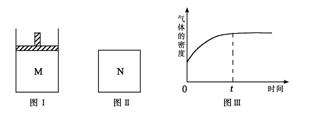
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
难度: 中等查看答案及解析
-
用惰性电极以直流电串联电解分装在甲、乙两烧杯中的200mL0.3 mol·L-1 NaCl溶液和300mL0.2 mol·L-1的AgNO3溶液,当产生0.56L(标准状况下)Cl2时停止电解,取出电极,将两杯溶液混合,则混合液的pH为(设混合后溶液的总体积为500mL)( )
A.1.4 B.7 C.5.6 D.12.6
难度: 中等查看答案及解析
-
将a L SO气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,反应后测得气体体积增大了b L(气体体积均在同温同压下测定),则下列叙述正确的是 ( )
A.SO的转化率为
B.混合气体的平均相对分子质量为
C.反应前与反应后气体的密度之比为
D.混合气体中SO的体积分数为
难度: 中等查看答案及解析
-
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的 ( )
A.肯定有A13+、Mg2+、NH4+、Cl— B.肯定有Al3+、Mg2+、HCO3—
C.肯定有K+、HCO3—、MnO4— D.肯定有A13+、Mg2+、SO42—
难度: 中等查看答案及解析
-
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )

A.AB段发生反应的离子方程式为:
B.BC段发生反应的离子方程式为:H+ + OH-=H2O
C.D点表示的沉淀的化学式为
、
D.E点表示的溶液呈中性
难度: 中等查看答案及解析
-
下列比较中,正确的是( )
A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
B.0.2mol/L NH4NO3和0.1 mol/L NaOH溶液等体积混合后:
c(NH)>c(NO)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH)由大到小的顺序是:①>②>④>③
难度: 中等查看答案及解析
-
某化学科研小组研究在其他条件不变,改变某一条件对A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响时,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论正确的是 ( )

A.反应速率a>b>c
B.达到平衡时,A2的转化率大小为:b>a>c
C.若T2>T1,则正反应是吸热反应
D.达到平衡时,AB3的物质的量大小为:c>b>a
难度: 中等查看答案及解析

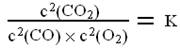 ,K是一个只与温度有关的常数,称为化学平衡常数。
,K是一个只与温度有关的常数,称为化学平衡常数。