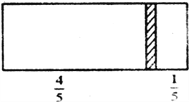
-
工业上曾经通过反应“3Fe+4NaOH= Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是
A. 用磁铁可以将Fe与Fe3O4分离 B. 将生成的气体在空气中冷却可获得钠
C. 该反应中的氧化剂NaOH D. 每生成22.4LH2,转移的电子数一定为4×6.02×1023
难度: 困难查看答案及解析
-
有些科学家提出硅是“21世纪的能源”,下列有关硅及其化合物的说法正确的是
A. 硅在自然界中以游离态和化合态两种形式存在
B. 硅晶体是良好的半导体,可用于制造光导纤维
C. SiO2是酸性氧化物,不与任何酸发生反应
D. 木材浸过水玻璃后,不易着火
难度: 简单查看答案及解析
-
向一定量的铜和三氧化二铁的混合物中加入200mL 1.5molL的稀硫酸,完全反应后固体无剩余,所得溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法错误的是
A. 原混合物中Cu和Fe2O3的质量之比为2∶5
B. 反应后的溶液中CuSO4的物质的量的浓度为1mol/L
C. 若用CO还原等质量的原混合物,充分反应后,质量将减少4.8克
D. 若向反应后的溶液加酸性KMnO4溶液(此条件下还原产物为Mn2+),完全反应后,将消耗KMnO4 0.04mol
难度: 中等查看答案及解析
-
下列实验操作正确的是
A. 用苯萃取溴水中的溴时,将溴的苯溶液从下口放出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
D. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
难度: 简单查看答案及解析
-
下列有关金属的说法中,正确的是
A. “真金不怕火炼”是指金的熔点高
B. 铝在空气中耐腐蚀,所以铝是不活泼金属
C. 人类对金属材料的使用过程中,性质活泼的金属单质最早被人们使用
D. 铝钠合金若投入一定的水中可得无色溶液,则n (Al)≤n (Na)
难度: 简单查看答案及解析
-
下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物改变的是
A. Fe 和HCl B. Na2CO3 和HCl C. Na 和O2 D. KAl(SO4)2和Ba(OH)2
难度: 简单查看答案及解析
-
下列有关过氧化钠的说法错误的是
A. Na2O2用作呼吸面具的供氧剂
B. 将Na2O2投入FeCl2溶液中,可观察到生成红褐色沉淀
C. Na2O2与CO2反应生成0.1mol O2时转移电子0.4 mol
D. 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 中等查看答案及解析
-
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
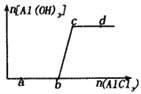
A. a点对应的溶液中: Na+、K+、SO42-、HCO3-
B. b点对应的溶液中:Na+、ClO-、SO42-、Cl-
C. c点对应的溶液中: Ag+、H+、Ca2+、NO3-
D. d 点对应的溶液中: K+、NH4+、OH-、Cl-
难度: 中等查看答案及解析
-
Mg、Al、Fe 三种金属的混合物与足量的稀硫酸反应,生成11.2LH2 (标准状况) 则三种金属的物质的量之和可能是
A. 0.3mol B. 0.4mol C. 0.55 mol D. 0.6mol
难度: 中等查看答案及解析
-
将足量的CO2不断通入NaOH、Ca (OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为
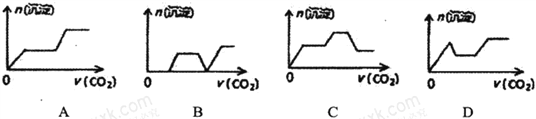
A. A B. B C. C D. D
难度: 困难查看答案及解析
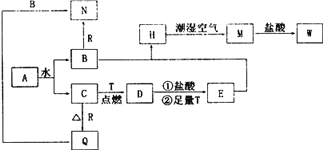
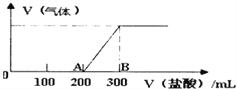
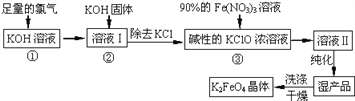
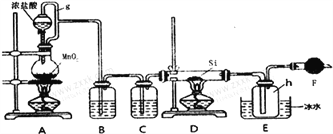
 测定剩余固体质量。
测定剩余固体质量。