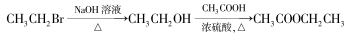-
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,下列做法不正确的是
A.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.铁强化酱油可通过膳食补充人体所需的铁元素
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同
难度: 中等查看答案及解析
-
化学与人类的生活密切相关,下列说法中正确的是
A.烧鱼时,先加酒后又加醋,产生香味是因为生成大量的乙酯乙酯
B.在鸡蛋清中加入食盐,搅拌均匀,静置后会出现凝聚现象
C.纯碱水溶液呈碱性,纯碱属于碱类
D.SO2有漂白作用,可用于食材的漂白
难度: 中等查看答案及解析
-
下列关于元素及其化合物的说法正确的是
A.Fe 在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
C.Na久置于空气中,可以与空气中的有关物质发生反应,最终生成Na2CO3粉末
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
难度: 中等查看答案及解析
-
下列说法正确的是
A.CO(g)的燃烧热:△H=-283.0KJ/ mol,则 2CO2(g ) =2CO(g)+O2(g)反应的△H= -55.0KJ/ mol
B.已知NaOH(aq) +HCl(aq )= NaCl(aq) +H2O(l) △H = -57.30KJ/ mol-1 ,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出57.3KJ的热量
C.已知2C(s)+2O2(g)=2CO2 (g) △H=a;2C(s)+O2 (g )=2CO(g) △H=b;则a>b
D.已知c(石墨,s)= C(金刚石,s) △H>0,则石墨比金刚石稳定
难度: 中等查看答案及解析
-
我国药物化学家屠吆吆用乙醚提取青蒿素,得到具有高效抗疟作用青蒿素,为此获得 2015 年诺贝尔生理学或医学奖的一半授予。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图)。 下列说法不正确的是
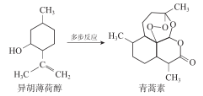
A.异胡薄荷醇可以与溴水发生加成反应
B.异胡薄荷醇含有一个苯环结构
C.青蒿素易溶于乙醚
D.青蒿素分子中碳氧原子个数比3:1
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4+
B.(NH4) 2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe 2++2OH-= Fe(OH) 2↓
C.澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
D.向 Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-=Mg(OH)2↓+2CO32-+2H2O
难度: 中等查看答案及解析
-
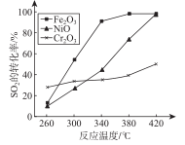
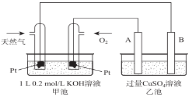
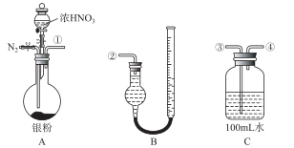
由下列实验现象得出的结论正确的是

难度: 中等查看答案及解析
-
下列推断正确的是
A.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物
B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 中等查看答案及解析
-
设NA为阿伏加罗常数的值,下列叙述正确的是
A.在标况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
B.常温常压下,16gO3所含的电子数为8NA
C.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
难度: 简单查看答案及解析
-
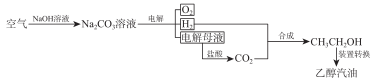
人工模拟光合作用,设计的电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
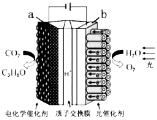
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.该转化过程中,水得到电子
D.反应为6CO2+8H2O
2C3H8O+9O2
难度: 中等查看答案及解析
-
下列说法正确的是
A.水中滴入盐酸,水的电离度会增加
B. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH<7
C.25℃时,0.1mol·L -1的硫化氢溶液比等浓度的硫化钠溶液的导电能力强
D.0.1 molAgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl - )>c(I - )
难度: 中等查看答案及解析
-
五种短周期主族元素 A、B、C、D、E 的原子序数依次递增,A2属于绿色燃料,C的氧化物常用于玻璃的生产,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C 为同周期元素,B、D 原子最外层电子数之和等于E的最外层电子数。 根据以上叙述,下列说法中正确的是
A.五种元素中B元素的金属性最强
B.元素D、E分别与元素A形成化合物的稳定性:A2D>AE
C.元素C、D、E的最高价氧化物对应水化物的酸性递减
D.元素B、D、E的简单离子半径大小为:B>D>E
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.邻二甲苯苯环上的一氯取代产物有2种
B.甲苯分子中最多有12个原子在同一平面内
C.乙二醇与甘油互为同系物
D.油脂在烧碱溶液中能发生水解反应
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.基态原子的4S能级中只有1个电子的元素共有4种
B.
得电子能力不相同
C.Cl-、S2-、Na+、K+半径逐渐减小
D.最外层有3个未成对电子的原子一定属于主族元素
难度: 中等查看答案及解析
-
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
A.绿色化学的核心是对环境污染进行综合治理
B.烟、云、雾在阳光照射下可观察到丁达尔现象
C.光化学烟雾、酸雨的形成都与氮氧化物有关
D.利用高纯硅可以制成光电池,将光能直接转化为电能
难度: 中等查看答案及解析