-
北魏贾思勰《齐民要术·作酢(zuò,今醋也)法》这样描述乌梅苦酒法:“乌梅去核,一升许肉,以五升苦酒渍数日,曝干,擣作(dǎo,同“捣”)作屑。欲食,辄投水中,即成醋尔。”下列有关醋的说法中正确的是
A. 醋的主要成分是非电解质 B. 醋的主要成分是强电解质
C. 醋的主要成分是弱电解质 D. 醋中只存在分子,不存在离子
难度: 简单查看答案及解析
-
下列物质的电离方程式书写正确的是
A. NaHCO3=Na++H++CO32- B. H2SO4
2H++SO42-
C. HClO =H++ClO- D. Ba(OH)2=Ba2++2OH-
难度: 简单查看答案及解析
-
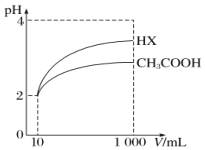
下列物质溶于水中形成l mol·L-1的溶液时,导电能力最强的是
A. HCl B. H2SO4
C. CH3COOH D. CH3CH2OH
难度: 简单查看答案及解析
-
由水电离产生的c(H+)为1×10-12 mol • L-1的溶液中,能大量共存的离子组是
A. K+、Cl-、NH4+、S2- B. K+、Fe2+、I-、NO3-
C. Na+、Cl-、NO3-、SO42- D. Na+、Ca2+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列热化学方程式的反应热表示可燃物的燃烧热的是
A. H2(g)+I2(g)
2HI(g) △H=-9.48 kJ • mol-1
B. CH4(g)+2O2(g)=2H2O(g)+CO2(g) △H =-802.3 kJ • mol-1
C. 2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ • mol-1
D. H2(g)+
O2(g)=H2O(l) △H=-285.8 kJ • mol-1
难度: 简单查看答案及解析
-
下列各项关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项
强电解质
弱电解质
非电解质
A
CaCO3
HF
SO2
B
NaCl
NH3
BaSO4
C
Fe
HCl
蔗糖
D
HNO3
Fe(OH)3
MgO
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列实验装罝不能达到相应实验目的的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质的水溶液中,除了水分子外,不存在其他分子的是
A. NaHSO4 B. CH3COONH4 C. Na2S D. NH3 • H2O
难度: 简单查看答案及解析
-
在一定条件下,将A2和B2两种气体通入1 L密闭容器中发生反应:xA2(g)+yB2(g)=2C(g),2 s时测得v(A2)=0.4 mol·L-1 • s-1,v(B2)=1.2 mol • L-1 • s-1,v(C)=0.8 mol • L-1 • s-1。则x和y的值分别为
A. 1和3 B. 3和2 C. 3和1 D. 2和3
难度: 简单查看答案及解析
-
在恒容密闭容器中,反应:CO(g)+H2S(g)
COS(g)+H2(g)达到平衡后,向反应容器中再分别充入下列气体,能使CO的转化率增大的是
A. COS B. H2 C. H2S D. CO
难度: 简单查看答案及解析
-
下列措施能使氨水的电离平衡逆向移动的是
A. 加入少量水 B. 加入少量MgCl2 固体
C. 通入少量HCl 气体 D. 加入少量NH4Cl 固体
难度: 简单查看答案及解析
-
在恒温恒容容器中,不能说明反应:C(s) +CO2(g)
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
难度: 简单查看答案及解析
-
室温下,等体积的酸溶液和碱溶液混合后pH —定等于7的是
A. pH=3的盐酸和pH=11的氨水
B. pH=3的盐酸和pH=11的KOH溶液
C. pH=3的硫酸和pH=13的NaOH溶液
D. pH=3的醋酸和pH=11的KOH溶液
难度: 中等查看答案及解析
-
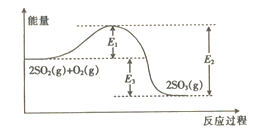
现有下列两个图像:
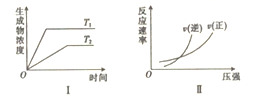
下列反应中同时符合上述两个图像的是
A. 2HI(g)
H2(g)+I2(g) △H>0
B. 2SO2(g)+O2(g)
2SO3(g) △H<0
C. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H<0
D. N2O4(g)
2NO2(g) △H>0
难度: 中等查看答案及解析
-
一定条件下,在密闭容器中充入一定量的X和Y发生可逆反应:X(g)+2Y(g)
3Z(g),达到平衡时,测得Y的转化率为37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为
A. l:3 B. 3:1 C. 4:3 D. 3:4
难度: 中等查看答案及解析
-
室温时,向20mL0.1mol·L-1 醋酸溶液中不断滴入0.1mol·L-1 的NaOH溶液,溶液pH 变化如图所示。下列叙述错误的是
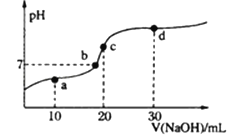
A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. c 点:c(OH-)=c(CH3COOH)+c(H+)
D. d 点:2c (Na+)=3[c(CH3COOH)+ c(CH3COO-)]
难度: 困难查看答案及解析