-
工业上制硫酸的主要反应之一为2SO2(g)+O2(g) 2SO2(g),反应过程中能量的变化如图所示。
2SO2(g),反应过程中能量的变化如图所示。

(1)由图可知该反应的正反应为_________ (填“吸热”或“放热”) 反应。
(2)向反应体系中加入催化剂后,图中E1_______(填“增大”“或“减小”或“不变”,下同),E3______。
(3)已知:2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-442.4kJ/mol
S(s)+O2(g)==SO2(g) ΔH=-297.0 kJ/mol 。
若H2S(g)与O2(g)反应产生SO2(g)和H2O(g),则消耗0.5mol H2S时,反应中转移的电子总数为_______(用NA 表示阿伏加德罗常数的数值),放出的热量为_______kJ。
-
工业上制硫酸的主要反应之一为2SO2(g)+O2(g) 2SO3(g),反应过程中能量的变化如图所示。
2SO3(g),反应过程中能量的变化如图所示。
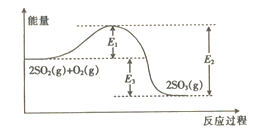
(1)由图可知该反应的正反应为_____________(填“吸热”或“放热”)反应。
(2)升高温度,平衡向_________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率_____________。
(3)向反应体系中加入催化剂后,图中E1____(填“增大”“减小”或“不变”,下同),E3___________。
(4)已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-442.4 kJ·mol-1;
S(s)+O2(g)=SO2(g) △H=-297.0 kJ • mol-1。
则H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是_________________,当此反应转移3 mol电子时,放出的热量为_______kJ。
-
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应
2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
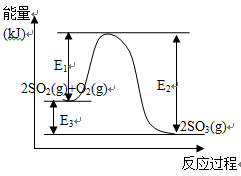
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为_______,反应放出_____________热量。(用E1、E2或E3表示)
(2)下列叙述能证明该反应已达化学平衡状态的是__________________(填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体原子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3 ____________(填“增大”“减小”或“不变”)
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:______________________________________________。

(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式_________________。
-
(12分)硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_________,E的大小对该反应的反应热有无影响?___________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
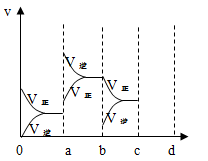
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
-
(12分)硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
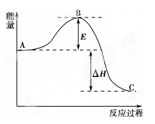
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_____________,E的大小对该反应的反应热有无影响?_______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=____________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
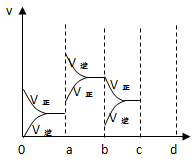
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
-
二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
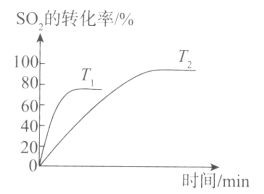
①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
| 投料比 | a | b | c | d |
| SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:
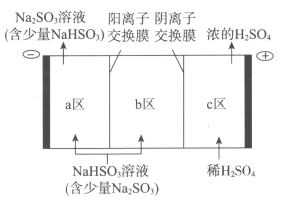
i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。
-
已知:2SO2(g) + O2(g)  2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是
2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是

A.反应的ΔH<0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
-
已知:2SO2(g)+O2(g) 2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )
2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )
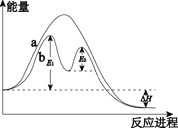
A.反应的ΔH<0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
-
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。下列说法错误的是:( )

A. 图中A表示反应物的总能量
B. 图中E的大小对该反应的△H有影响
C. 该反应通常用V2O5作催化剂,加V2O5会使图中B点降低
D. 加入催化剂V2O5后,该反应的△H不变
-
已知:2SO2(g) + O2(g)⇌2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是
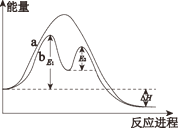
A.反应的 ΔH<0
B.过程b 使用了催化剂
C.过程b 发生两步反应,第一步为吸热反应
D.使用催化剂可以降低反应活化能,提高 SO2 的平衡转化率
2SO3(g),反应过程中能量的变化如图所示。













