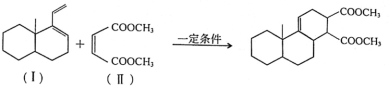
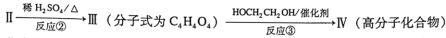-
下列关于有机物的说法正确的是
A.乙醇和甘油互为同系物
B.分子式为C7H8O且分子中有苯环的有机物共有4种
C.苯乙烯分子中所有原子可能在同一个平面上
D.除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液
难度: 中等查看答案及解析
-
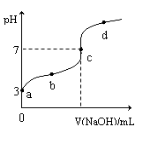
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
难度: 困难查看答案及解析
-
下图是某有机物分子的简易球棍模型。下列 关于该有机物的说法中错误的是
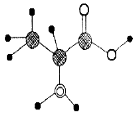
A.分子式为C3H7O2N
B.该有机物能跟NaOH溶液反应,也能和盐酸反应
C.能通过聚合反应生成高分子化合物
D.具有相同官能团的该有机物的同分异构体还有两种
难度: 中等查看答案及解析
-
已知常温下CH3COOH的电离平衡常数为Ka ,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
A. a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol·L-1
B. b点表示的溶液c(CH3COO-)< c(Na+)
C. b、d点表示的溶液中
相等
D. c点表示CH3COOH和NaOH恰好反应完全
难度: 困难查看答案及解析
-
下列实验中,现象和离子方程式正确的是
操作
现象
离子方程式
A
用CH3COOH溶液浸泡水垢
水垢溶解,有无色气泡
CaCO3+2H+=Ca2++H2O+CO2↑
B
向NaAlO2溶液中通入过量CO2
产生白色沉淀
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C
向FeBr2溶液中通入过量Cl2
溶液由浅绿色变成黄色
Cl2+2Fe2+ =2Cl- +2Fe3+
D
用石墨电极电解滴有酚酞的饱和NaCl溶液
在两极有气体产生,阴
极附近溶液呈现红色
2Cl-+2H2O
Cl2↑+H2↑+2OH-
难度: 中等查看答案及解析
-
高功率LaNi5H6 (氢的化合价为0价)电池已经用于混合动力汽车。总反应如下:LaNi5H6+6NiO(OH)
LaNi5+6Ni(OH)2
下列叙述正确的是
A.充电时储氢合金作阳极
B.放电时每转移6mol电子,有6moLNiO(OH)被氧化
C.充电时阳极周围pH增大
D.放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O
难度: 中等查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为49,最外层电子数之和为17;工业上制取金属Y一般通过电解其与W形成的化合物方法;W、Z最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
A.Q、W、Z、Y、X原子半径依次增大
B.元素W与元素Z的最高化合价相同
C.Q和X形成的化合物中含有离子键
D.Z元素的简单离子与含有Y元素的离子在水溶液中可能大量共存
难度: 中等查看答案及解析