-
化学与生活密切相关,以下说法不正确的是 ( )
A.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
B.明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
D.食醋可用于除去暖水瓶中的水垢
难度: 中等查看答案及解析
-
某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中能生成一种白色的胶状沉淀,则X是 ( )
A.SiO2 B.Al2O3 C.MgO D.P2O5
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.1mol NO2与足量H2O反应,转移电子数为2NA
B.1L0.5mol/L Na2CO3溶液中的阴离子数目小于0.5NA
C.标准状况下,22.4L任意比的氢气与氧气的混合气体中含有的分子总数均为NA
D.10g H218O中所含的中子数为4NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在溶液中一定能大量共存的是 ( )
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl—、SO2—4
B.与铝反应产生大量氢气的溶液:Na+、K+、HCO—3、NO—3
C.由水电离产生的c(H+)=10-13mol/L的溶液:NH+4、Ba2+、AlO—2、Cl—
D.pH=12的溶液:K+、Na+、CH3COO—、Br—
难度: 中等查看答案及解析
-
下列说法中,不正确的是 ( )
A.石油的分馏主要是物理变化而煤的干馏主要是化学变化
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体
D.生活中食用的食醋、植物油、动物蛋白等物质都是混合物
难度: 中等查看答案及解析
-
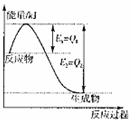
下列关于反应热的描述中正确的是 ( )

难度: 中等查看答案及解析
-
将磁性氧化铁放出稀HNO3中可发生如下反应:
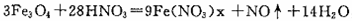 ,下列判断合理的( )
,下列判断合理的( )A.Fe(NO3)x中的x为2
B.稀HNO3在反应中只表现氧化性
C.反应中每还原0.4mol氧化剂,就有1.2mol电子转移
D.磁性氧化铁中的所有铁元素全部被氧化
难度: 中等查看答案及解析
-
从下列事实所得出的相应结论正确的是 ( )

A.②③⑤ B.③④⑤ C.①②③ D.全部
难度: 中等查看答案及解析
-
下列解释实验事实的方程式不正确的是 ( )

难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程为:

 ,下列各组实验中最先出现浑浊是( )
,下列各组实验中最先出现浑浊是( )
难度: 中等查看答案及解析
-
原子的核电荷数小于18个某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2—1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成的化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
难度: 中等查看答案及解析
-
控制合适的条件,将反应

设计成如图所示的原电池。下列判断不正确的是( )
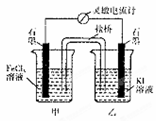
A.反应开始时,乙中石墨电极上发生的电极反应式为2I——2e—===I2
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为负极
难度: 中等查看答案及解析
-
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动,下列叙述正确的是( )
①生成物的质量分数一定增加; ②生成物的物质的量一定增加;
③反应物的转化率一定增大; ④平衡时反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率; ⑥一定使用了催化剂;
A.①②⑤ B.④⑥ C.②⑤ D.③④⑤
难度: 中等查看答案及解析
-
下列实验报告记录的实验现象正确的是 ( )

难度: 中等查看答案及解析
-
已知A、B为单质,C为化合物。能实现下述转化关系的是 ( )

①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
难度: 中等查看答案及解析
-
在一定容器闭容器中通入A、B两种气体,一定条件下发生如下反应:
 达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是 ( )
达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是 ( )
难度: 中等查看答案及解析
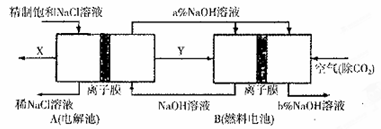
 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: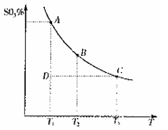
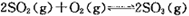 的△H
的△H