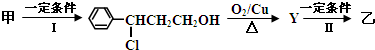-
下列有关说法正确的是( )
A.乙烯和苯都能与溴水反应
B.用饱和Na2CO3溶液可以将乙醇和乙酸鉴别开来
C.葡萄糖和淀粉在一定条件下都能发生水解反应
D.苯不能使KMnO4溶液褪色,所以苯不能发生氧化反应难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.58.5g氯化钠中约含有6.02×1023个氯化钠分子
B.常温常压下,2.24L C2H4中含有共用电子对的数目为0.6NA
C.0.1mol Na2O2与足量的水反应,转移电子数为0.2NA
D.200mL 0.5mol•L-1的Na2CO3溶液中碳酸根离子数目小于0.1NA难度: 中等查看答案及解析
-
X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
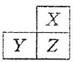
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.y和z的最高价氧化物对应水化物均为强酸
D.若z的最高正价为+m,则X的最高正价也一定为+m难度: 中等查看答案及解析
-
下列各组离子,一定能在指定环境中大量共存的是( )
A.在含有大量I-离子的溶液中:Cl-、Fe3+、Al3+、Cu2+
B.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-能够大量共存
C.在由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、Cl-、Br-
D.在加入Al能放出大量H2的溶液中:NH4+、SO42-、C1-、HCO3-难度: 中等查看答案及解析
-
下列有关以KOH溶液为电解液的氢氧燃料电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-=4OH-
B.工作一段时间后,电解液中KOH的物质的量浓度不变
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.2mol电子转移难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )

A.实验室用装置①制取氨气
B.装置②中X若为苯,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可用于检验火柴头燃烧产生的SO2难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Na和Cs属于第IA族元素,Cs失去电子能力比Na强
B.Na2O2与水反应、红热的Fe与水蒸气反应均能反应生成碱
C.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
D.镁条在空气中燃烧生成的氧化物是MgO,钠在空气中燃烧生成的氧化物是Na2O2难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下pH为5的盐酸溶液稀释1000倍后,pH等于8
B.浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者
C.碳酸钠溶液中存在:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
D.等物质的量浓度的CH3COOH溶液与KOH溶液任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-)难度: 中等查看答案及解析