-
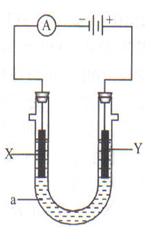
有关原电池的工作原理中的下列说法中不正确的是( )
A.电池负极发生氧化反应
B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路)
D.电流方向是从负极流向正极(外电路)
难度: 简单查看答案及解析
-
现在探索、开发的新能源有:( )
①核能 ②柴草 ③煤炭 ④太阳能 ⑤氢能 ⑥液化石油气
⑦水煤气 ⑧天然气
A、①④⑤ B、②③⑥⑦ C、③⑥⑦⑧ D 、①②④
难度: 简单查看答案及解析
-
下列关于物质的分类中,均正确的是 :( )
A.铜丝——电解质;氢氧化钾——电解质
B.二氧化硫——电解质;氧化钙——电解质
C.NaCl溶液——非电解质;酒精——非电解质
D.氧气——不属于电解质或非电解质;熔融的MgCl2——电解质
难度: 简单查看答案及解析
-
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )
A. 加入适量的6mol/L的盐酸 B. 加入数滴氯化铜溶液
C. 加入适量蒸馏水 D. 加入适量的氯化钠溶液
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增加,非自发反应一定是熵不变或减少
C. 自发反应在恰当的条件下才能实现
D. 自发反应在任何条件下才能实现
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增大容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 简单查看答案及解析
-
下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.1/2H2(g)+ 1/2Cl2(g)= HCl(g);△H=-92.3kJ/mol
B.CH4(g)+ 2O2(g)= CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+ O2(g)= 2H2O(l);△H=-571.6kJ/mol
D.CO(g)+ 1/2O2(g)= CO2(g);△H=-283kJ/mol
难度: 简单查看答案及解析
-
下列各变化中属于原电池的反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面锌有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面表成蓝黑色保护层
D.锌和稀硫酸反应时,加入少量的蒸馏水可使反应减慢
难度: 简单查看答案及解析
-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O
HCOO-+H3O+ B.CO+H2O
HCO+OH-
C.CO2+H2O
HCO+H+ D.HS-+H2O
.S2-+H3O+
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-==Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-== 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-== Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e- == Fe2+
难度: 简单查看答案及解析
-
判断溶液的酸碱性有多种方法。下列溶液中,一定呈碱性的是( )
A.能够使甲基橙呈现黄色 B.溶液的pH>7
C.溶液中:c(H+)<c(OH-) D.溶液中:c(H+)>1×10-7mol·L-1
难度: 简单查看答案及解析
-
常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得溶液的pH ( )
A.等于7 B.大于7 C.小于7 D.无法确定
难度: 简单查看答案及解析
-
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)
2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是: ( )
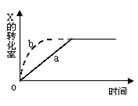
A.增大体积 B.增大Y的浓度
C.降低温度 D.缩小体积
难度: 简单查看答案及解析
-
有关AgCl沉淀的溶解平衡说法正确的是
A.AgCl沉淀生成和沉淀溶解的速率都等于零
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶度积(Ksp)不变
D.升高温度,AgCl沉淀的溶解度不变
难度: 简单查看答案及解析
-
在氯化铵溶液中,下列关系式正确的是 ( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)> c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D.c(NH4+)= c(Cl-)>c(H+)>c(OH
难度: 简单查看答案及解析
-
一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体)
Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是: ( )
A.溶液中氢氧根离子浓度增大 B.溶液中钡离子浓度减少
C.溶液中钡离子数目减小 D.pH减小
难度: 简单查看答案及解析
-
下列各组离子能在PH=0的无色溶液中大量共存的是( )
A. Mg2+、Cl-、Na+、SO42- B. Ba2+、Na+、NO3-、MnO4-
C. K+、Cl-、HCO3-、NO3- D. Ca2+、Na+、Fe3+、CO32-
难度: 简单查看答案及解析
-
已知Fe2O3(s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则2Fe(s)+O2(g)=Fe2O3(s)的△H是( )
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
难度: 简单查看答案及解析
-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为:( )
A. 0.1mol B.0.2mol C.0.3mol D.0.4mol
难度: 简单查看答案及解析