-
某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A. 肯定不含I- B. 可能含SO42-
C. 肯定含有SO32- D. 肯定含有NH4+
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A. “歼﹣20”飞机上大量使用的碳纤维是一种新型的有机高分子材料
B. 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝
C. 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入纳米时代。利用此类光学显微镜可以观察具有丁达尔效应的分散系中的分散质
D. 酸碱指示剂变色、煤的液化、海水提取溴、焰色反应都涉及化学变化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是 ( )
A. 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
B. 50mL 18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
C. 标准状况下2.24 L HF,分子数为0.1 NA
D. 将1 mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 由同种元素组成的物质一定是单质
B. 胆矾、冰水混合物、四氧化三铁、冰醋酸都不是混合物
C. 葡萄糖溶液和淀粉溶液作为分散系的本质区别是能否发生丁达尔效应
D. 同温、同压下等质量的SO2气体和CO2气体,体积比为16∶11,密度比为11∶16
难度: 中等查看答案及解析
-
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的是( )
选项
实验目的
实验仪器或装置
A
除去KCl中少的 MnO2
烧杯、玻璃棒、分液漏斗
B
用10mol/L的盐酸配制100mL0.1mol/L的盐酸
100mL容量瓶、玻璃棒、烧杯
C
用氯化钠溶液制备氯化钠晶体
D
用右图装置验证SO2的漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是 ( )
A. 磁性氧化铁溶于稀硝酸:3FeO+4H++ NO3-=3Fe3++NO↑+2H2O
B. 向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-
C. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJ•mol-1,假设每摩尔冰中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=(ca)2/c(1-a)。若加水稀释,,则CH3COOH
CH3COO-+H+向右移动,a增大,Ka不变
C. 甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
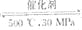 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1难度: 中等查看答案及解析
-
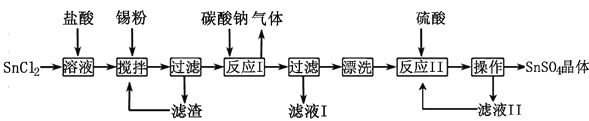
用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,发生如下反应:
①
CaSO4(s)+CO(g) ⇌
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) ⇌ CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g) ⇌
C(s)+
CO2(g) ΔH3=-86.2 kJ·mol-1
下列说法错误的是 ( )
A. 反应①达到平衡时,增大压强平衡不移动
B. 反应②的平衡常数表达式为K=

C. 反应①和②是主反应,反应③是副反应
D. 2CaSO4(s)+7CO(g)
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
难度: 中等查看答案及解析
-
石墨烯是目前发现的最薄、最坚硬、导电导热性能最强的一种新型纳米材料,有“新材料之王”美誉的石墨烯又被称为“黑金”,科学家预言石墨烯将“彻底改变21世纪”。中科院研究人员开发研制的一种石墨烯锂硫电池具有理论能量密度高 (2600 Wh/kg),且单质硫价格低廉、环境友好等优点,其工作原理:2Li+S8=Li2S8如图所示,下列有关该电池说法正确的是 ( )
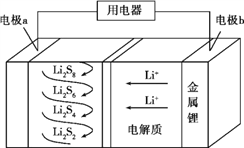
A. B电极发生还原反应
B. A电极上发生的一个电极反应为:2Li++S8+2e-=Li2S8
C. 电池工作时,外电路中流过0.01mol电子,负极材料质量减重0.14g
D. 电子从B电极经过外电路流向A电极,再经过电解质流回B电极
难度: 中等查看答案及解析
-
在一密闭容器中发生反应:2X(g)+Y(g)
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是

A. 图甲,P1>P2,a < 3
B. 图甲,T1<T2,Q>0
C. 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D. 图乙,如果a=3, t2时表示向体系中加入了催化剂
难度: 困难查看答案及解析
-
α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为:

在T℃时,向2.0 L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min
0
1
2
5
10
n(HCl)/mol
0
0.12
0.20
0.32
0.32
下列有关说法正确的是 ( )
A. 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol·L-1·min-1
B. 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH<0
C. 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 mol α-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行
D. 在T℃时,起始时若向容器中充入2.0mol α-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20%
难度: 困难查看答案及解析
-
一定温度下,在一固定体积的密闭容器中发生反应A(s)+3B(g)⇌2C(g),下列说法中能说明该反应达到化学平衡状态的是( )
①C的生成速率和C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C的物质的量之比为1∶3∶2
⑥混合气体的平均相对分子质量不变
A. ②④⑤ B. ①③④⑥ C. ①②④⑥ D. ①②③④⑤
难度: 中等查看答案及解析
-
下图所示与对应叙述相符的是( )

A. 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图1可确定首先沉淀的是A-
B. 图2表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应
C. 一定条件下,X和Y反应生成Z,由图3推出该反应的方程式可表示为:X + 3Y
Z
D. 图4表示溶液中反应:I2 + I-⇌ I3- 平衡c(I3-) 随温度变化,反应速度v(正)M>v(逆)N
难度: 困难查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A. 0.1 mol.L-1 的 NaHA 溶液 pH=l 则有:c(Na+)= c(H2A) + c(HA-) + c(A2-)
B. 强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)= c(A-)
C. pH相等的CH3COONa 和Na2CO3 两种溶液:c(CH3COONa)<c(Na2CO3)
D. NaHSO3 溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)> c(OH-)
难度: 困难查看答案及解析
-
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2 (g) +3H2 (g)
CH3OH(g)十H2O (g);ΔH= -25kJ·mol-1。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析不正确的是( )
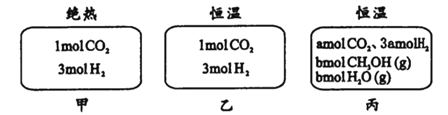
A. 刚开始反应时速率:甲=乙 B. 平衡后反应放热:甲<乙
C. 若a≠0,则0.9<b<l D. 500℃下该反应平衡常数K =3×102
难度: 困难查看答案及解析
-
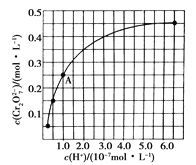
常温时,1 mol/L的HClO2和,1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是 ( )
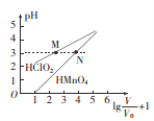
A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C. 在0≤pH≤5时,HMnO4溶液满足,pH=
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
难度: 困难查看答案及解析