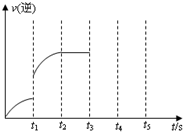
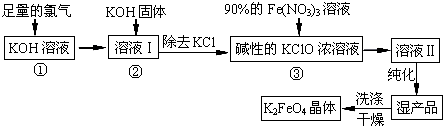
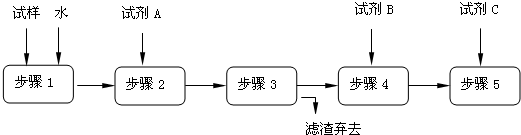
-
下列化学反应的离子方程式正确的是( )
A.将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑
C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
D.向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O难度: 中等查看答案及解析
-
下列叙述正确的是(NA为阿伏伽德罗常数)( )
A.标况下,22.4L苯的分子数为NA
B.48gO3气体含有NA个O3分子
C.0.5mol•L-1CuCl2溶液中含有0.5NA个Cu2+
D.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA难度: 中等查看答案及解析
-
如图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )
He F S Cl
A.非金属性:F>S>Cl
B.原子半径:Cl>S>F
C.稳定性:HF>HCl>H2S
D.酸性:HF>HClO4>H2SO4难度: 中等查看答案及解析
-
下列化学用语或模型表示正确的是( )
A.Cl-离子的结构示意图:
B.CCl4分子的球棍模型:
C.乙烯的结构简式CH2CH2
D.H2O2的结构式:H-O-O-H难度: 中等查看答案及解析
-
为了防止大灾害后“霍乱疫情”的发生,一些卫生专家们建议使用15%的过氧乙酸(
)溶液对环境进行消毒,能够有效消除霍乱病菌.下列有关过氧乙酸的叙述错误的是( )
A.不易溶于水,易溶于有机溶剂
B.因为能使蛋白质变性,所以用来杀菌
C.属于烃的衍生物
D.具有氧化性难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.阳离子只能得到电子被还原,只能作氧化剂
B.海轮外壳上镶入锌块,可减缓船体的腐蚀
C.需要加热才能发生的反应一定是吸热反应
D.为减少中和滴定实验的误差,锥形瓶必须洗净并烘干后使用难度: 中等查看答案及解析
-
25℃时下列叙述正确的是( )
A.在0.1mol/L的NH3•H2O溶液中,c>c(NH4+)>c(OH-)>c(H+)
B.pH=2的HA酸溶液与pH=12的MOH碱溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
C.pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7
D.PH=8的CH3COOH和CH3COONa的混合溶液中:c(Na+)>c(CH3COO-)难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )

A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③是原电池,锌电极为负极,发生氧化反应
D.装置④可用于制备氢氧化亚铁并观察其颜色难度: 中等查看答案及解析