-
《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”, “以烧酒复烧二次……价值数倍也”。其方法与分离下列物质的实验方法原理上相同的是
A. 甲苯和水 B. 硝酸钾和氯化钠
C. 乙酸乙酯和乙酸 D. 食盐水和泥沙
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA
B.14g分子式为C3H8的链烃中含有的C-H的数目为2NA
C.室温时,1.0LpH=13的 Ba(OH)2溶液中含有OH-的数目为0.2NA
D.Fe与水蒸气反应生成22.4L氢气,转移的电子数为2NA
难度: 困难查看答案及解析
-
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
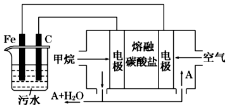
A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
难度: 困难查看答案及解析
-
从薄荷中提取的薄荷醇可制成医药。薄荷醇的结构简式如下图,下列说法正确的是
A.薄荷醇分子式为C10H20O,它是环己醇的同系物
B.薄荷醇的分子中至少有12个原子处于同一平面上
C.薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
D.在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期主族元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物溶于水后溶液呈碱性;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 简单的离子半径:W>Z>Y>X
B. 五种元素中只有X存在同素异形体
C. W和M形成的化合物是离子化合物
D. 工业上采用电解W和Z形成的化合物制备W单质
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
向KI溶液中加入CCl4,振荡后静置
液体分层,下两层呈紫红色
碘易溶于CCl4,难溶于水
B
向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化
溶液中产生白色沉淀,加稀硝酸不溶解
原溶液中一定含有SO42-
C
将西硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中
溶液变黄色
氧化性:H2O2比Fe3+强
D
向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体
溶液红色变浅
证明Na2CO3溶液中存在水解平衡
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
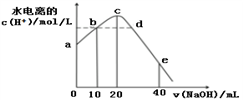
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
难度: 困难查看答案及解析
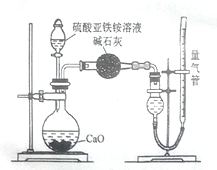
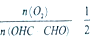 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图1所示。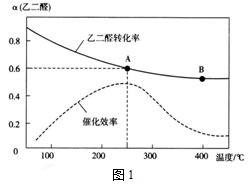
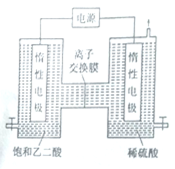
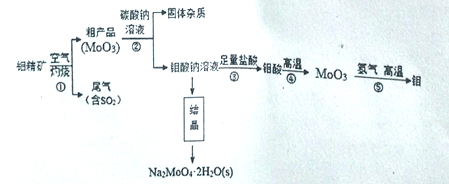

 ,写出以苯酚、乙醇和CH2ClCOOH为原料制备
,写出以苯酚、乙醇和CH2ClCOOH为原料制备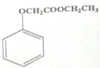 的合成路线流程图(无机试剂任用)。_____
的合成路线流程图(无机试剂任用)。_____