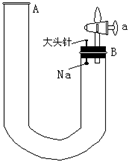
-
某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,有白色沉淀生成,继续滴加则沉淀消失;丁溶液滴入甲溶液中,无明显现象,据此可推断丙物质是( )
A.Al2(SO4)3
B.NaOH
C.BaCl2
D.FeSO4难度: 中等查看答案及解析
-
为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( )
A.浓盐酸
B.浓硝酸
C.浓硫酸
D.浓氢氧化钠溶液难度: 中等查看答案及解析
-
取两份等量的铝粉,分别与足量的盐酸、氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )
A.1:1
B.1:2
C.1:3
D.3:2难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu
B.稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑
C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑难度: 中等查看答案及解析
-
取一块用砂纸打磨过的铝箔在空气中加热至熔化,下列说法中不正确的是( )
A.铝失去了光泽
B.剧烈燃烧,火星四射
C.熔化的铝不滴落
D.在加热熔化过程中生成了氧化铝难度: 中等查看答案及解析
-
能用H++OH-=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.澄清石灰水和稀硝酸反应
D.二氧化碳通入澄清石灰水中难度: 中等查看答案及解析
-
下列反应中必须加入还原剂才能进行的是( )
A.Cl2→Cl-
B.Zn→Zn2+
C.H2→H2O
D.CuO→CuCl2难度: 中等查看答案及解析
-
0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl-的物质的量浓度之比( )
A.5:2
B.3:1
C.15:2
D.1:3难度: 中等查看答案及解析
-
把一小块金属钠放入下列溶液中,既能产生气体又会生成白色沉淀的是( )
A.稀硫酸
B.氢氧化钾稀溶液
C.硫酸铜溶液
D.氯化镁溶液难度: 中等查看答案及解析
-
为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH溶液
B.铁片
C.KSCN溶液
D.石蕊溶液难度: 中等查看答案及解析
-
如图所示,下列实验操作与方法正确的是( )
A. 检查容量瓶是否漏水的方法
检查容量瓶是否漏水的方法
B. 给溶液加热
给溶液加热
C.滴加液体
D. 过滤
过滤 难度: 中等查看答案及解析
-
下列说法正确的是( )
A.金属氧化物都是碱性氧化物
B.盐电离出的离子不一定有金属离子
C.由同种元素组成的物质一定是单质
D.非金属氧化物都是酸性氧化物难度: 中等查看答案及解析
-
下列关于蒸馏操作的有关叙述不正确的是( )
A.蒸馏操作主要仪器是:蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、温度计
B.蒸馏操作使用的温度计的水银球应插入到液体内
C.在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸
D.冷凝管进出水的方向是下进上出难度: 中等查看答案及解析
-
用铂丝做焰色反应实验,每次做完后都需要( )
A.用水洗涤2~3次后再使用
B.用滤纸擦干净即可使用
C.用盐酸洗涤,再用自来水洗净后使用
D.用盐酸洗涤,再灼烧至跟酒精灯火焰颜色相同后再使用难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.标准状况下,1mol任何物质体积均为22.4L
D.3.01×1023个SO2分子的质量为32g难度: 中等查看答案及解析
-
下列反应中,反应物中的各种元素都参加了氧化还原的是( )
A.2KNO3+S+3C═K2S+N2↑+3CO2↑
B.2KMnO4═K2MnO4+MnO2+O2↑
C.4HNO3═2H2O+4NO2↑+O2↑
D.HgS+O2═Hg+SO2难度: 中等查看答案及解析
-
同温同压下,等质量的下列气体所占有的体积最大的是( )
A.SO2
B.CH4
C.CO2
D.O2难度: 中等查看答案及解析
-
在反应中,元素X的原子将电子转移给元素Y的原子,则下列说法正确的是( )
①元素X被氧化②元素Y被氧化③元素X发生还原反应 ④元素Y发生还原反应.
A.①②
B.③④
C.②③
D.①④难度: 中等查看答案及解析
-
胶体区别于其它分散系的特征是( )
A.胶体粒子直径在1-100nm之间
B.胶体粒子带电荷
C.胶体粒子不能穿过半透膜
D.胶体粒子能够发生布朗运动难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为1NA
B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA
C.通常状况下,1NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA难度: 中等查看答案及解析
-
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnO4-、Na+、Cl-
B.K+、Na+、NO3-、CO32-
C.Na+、H+、NO3-、SO42-
D.Fe3+、Na+、Cl-、SO42-难度: 中等查看答案及解析
-
下列关于 Na2CO3 和NaHCO3 性质比较中正确的是( )
A.热稳定性:Na2CO3<NaHCO3
B.常温时水溶解性:Na2CO3>NaHCO3
C.与盐酸反应的快慢:Na2CO3>NaHCO3
D.相对分子质量:Na2CO3<NaHCO3难度: 中等查看答案及解析
-
Na2O2与水反应能够产生O2,这一反应在呼吸面具、潜水艇及太空飞船中可为人体提供呼吸所用的O2.下面对该反应的说法中正确的是( )
A.这是一个氧化还原反应,Na2O2既是氧化剂,又是还原剂
B.这是一个氧化还原反应,Na2O2是氧化剂,水是还原剂
C.这是一个氧化还原反应,Na2O2是还原剂,水是氧化剂
D.这是一个置换反应,有单质O2产生难度: 中等查看答案及解析
-
下列物质①NaHCO3②Al ③Al2O3 ④Al(OH)3中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
A.③④
B.①③④
C.③
D.全部难度: 中等查看答案及解析
-
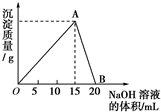
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH(aq),则消耗NaOH(aq)的体积(x轴)和生成沉淀量(y轴)之间的函数关系可用如图表示,其中正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1:1
B.3:4
C.2:3
D.4:3难度: 中等查看答案及解析