-
下列说法错误的是
A. 硅酸钠可以作为粘合剂和防火材料
B. 溶液、胶体、浊液都属于分散系,且均为液态
C. 人体缺碘会引起甲状腺肿大,碘元素还被誉为“智慧之花”
D. 通常所说的三大有机合成材料为:塑料、合成橡胶、合成纤维
难度: 简单查看答案及解析
-
分子式为C3H9N的有机物,N原子以三个单键与其他原子连接, 则该有机物可能的结构共有(不考虑立体异构)
A. 1种 B. 2种 C. 3种 D. 4种
难度: 中等查看答案及解析
-
氮氧化铝(AlON)是一种高硬度防弹材料,可以在高温下由反应Al2O3+C+N2
2AlON+CO合成,下列有关说法合理的是
A. 上述反应中氮气作还原剂
B. 氮氧化铝中氮元素的化合价是-3
C. 氮氧化铝晶体中的作用力是范德华力
D. 根据氮氧化铝晶体的硬度可推断其晶体类型可能与石英相同
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A. 4.0gNaOH所含电子总数为2NA
B. 18g重水(D2O)所含共价键总数为2NA
C. 1L0.1mol•L-1KHC2O4溶液中,HC2O4-、C2O42-的粒子数之和为0.1NA
D. 常温下,1LpH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
难度: 中等查看答案及解析
-
下列实验现象与对应结论均正确的是
选项
操作
现象
结论
A
常温下将铁片放入浓H2SO4中
剧烈反应生成刺激性气味气体
常温下铁易与浓H2SO4发生反应
B
Al2(SO4)3溶液中滴加过量稀氨水
先生成白色沉淀,随后又溶解
Al(OH)3能溶于氨水
C
向某溶液中滴加K3[Fe(CN)6]溶液
析出蓝色沉淀
该溶液中含有Fe2+
D
向某溶液中加入CCl4后震荡、静置
液体分层,下层呈紫红色
该溶液中的溶质为碘化物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得NaHSO3溶液以实现吸收液的回收再利用,装置如图所示,则工作一段时间后,下列说法正确的是
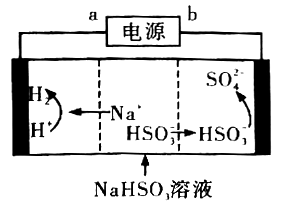
A. 电源a端是正极
B. 阴极区的pH减小
C. 阳极的电极反应式为HSO3--2e-+H2O=SO42-+3H+
D. 电路中每通过0.2mol电子,能产生2.24LH2
难度: 困难查看答案及解析
-
随原子序数递增,x、y、z、……等八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。

下列说法正确的是
A. x元素在周期表中的位置是第二周期ⅠA族
B. 离子半径:g2->h->d2->e+>f3+
C. 最高价氧化物对应水化物的酸性:y>z
D. 气态氢化物的热稳定性:g>h
难度: 中等查看答案及解析

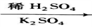


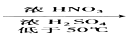
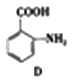
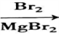
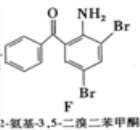
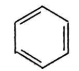 +CH3Cl
+CH3Cl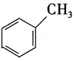 +HCl
+HCl