-
在日常生活中,下列解决问题的方法不可行的是
A.为加快漂白精的漂白速率,使用时可滴加几滴醋酸
B.为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
C.为减少“白色污染”,应严格执行“禁塑令”
D.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
难度: 简单查看答案及解析
-
下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是
A.Na2SO3 B.Na2O2 C.NaOH D.FeSO4
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0.1NA
B.标况下,11.2L NO2 所含的分子数目为0.5 NA
C.甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA
D.1 mol C2H6O分子中含有的O—H键数目一定为NA
难度: 困难查看答案及解析
-
液氨与纯水相似,也存在着微弱的电离:2NH3
NH4+ + NH2—,据此判断以下叙述中错误的是
A.NH3、NH4+、NH—的电子数相等,化学性质也相同
B.一定温度下液氨中c(NH4+)·c(NH2—)是一个常数
C.液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2—)
D.加入其他物质,c(NH4+)/c(NH2—)可能不变
难度: 困难查看答案及解析
-
在一定条件下,RO3n-与氟气可发生如下反应:RO3n- + F2 + 2OH- = RO4- + 2F- + H2O从而可知在RO3n-中,元素R化合价是
A、+4 B、+5 C、+6 D、+7
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向石灰水中逐渐通入过量CO2
②向Ca(ClO)2溶液中逐渐通入过量SO2
③向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
④向氯化钡溶液中逐渐通入过量二氧化硫
⑤向AgNO3溶液中逐滴滴入过量稀氨水
⑥向饱和碳酸钠溶液中逐渐通入过量二氧化碳
A.①②⑥ B.①③⑤ C.②④⑥ D.③④⑤
难度: 中等查看答案及解析
-
下列叙述正确的是
A.饱和石灰水中加入少量CaO,恢复至原温度后,溶液的pH不变
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.盐酸中
滴加氨水至中性,溶液中的溶质只有氯化铵
D.室温时pH=3的硫酸和pH=11的氨水等体积混合后,溶液的pH小于7
难度: 中等查看答案及解析
-
在一密闭容积的容器中进行反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达平衡时,可能存在的数据是( )
A.SO3为0.4 mol·L-1 B.SO2为0.3 mol·L-1,SO3为0.1 mol·L-1
C.SO2、SO3均为0.15 mol·L-1 D.O2为0.3 mol·L-1
难度: 中等查看答案及解析
-
下列措施有利于反应:N2(g)+3H2(g)
2NH3(g)△H=-92kJ•mol-1平衡
向正反应方向移动的是
①升高温度 ②降低温度 ③增大压强 ④减小压强 ⑤增大NH3浓度 ⑥减小NH3浓度
A.②④⑥ B.①③⑥ C.②③⑤ D.②
③⑥
难度: 中等查看答案及解析
-
在固定容积的密闭容器中,A和B发生下列反应,A(s)+2B(g)
2C(g)△H>0.在一定条件下达到平衡,若升高温度则达平衡后混合气体的
A.平均相对分子质量增大 B.平均相对分子质量减小 C.密度减小 D. 气体压强增大
难度: 中等查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A、CH3COOH溶液与Zn反应放出H2
B、0.1mol/LCH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol/LCH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
分别依据下列实验事实,得出的结论正确的是
实验事实
结论
A
将通入溴水中二氧化硫,溴水褪色
二氧化硫有漂白性
B
淀粉与稀硫酸共热,再加银
氨溶液水浴加热,无银镜生成
淀粉没有水解
C
铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解
硝酸钠可以加快铜与稀硫酸的反应速率
D
向1mL 0.1 mol/L的AgNO3溶液中加入1 mL 0.1 mol/L NaCl溶液,出现白色沉淀,再加几滴0.1 mol/L Na2S溶液,有黑色沉淀生成
氯化银的溶解度大于硫化银
难度: 困难查看答案及解析
-
下列表达式正确的是
A.热化学反应方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ·mol-1
B.用碳电极电解CuSO4溶液离子反应方程式:2Cu2++2H2O
2Cu↓+O2↑+4H+
C.用电子式表示H2O中化学键形成过程:H2+O→H:O:H
D.过量的CO2通入NaAlO2溶液的化学方程式:2NaAlO2+CO2+3H2O=Al(OH)3↓+Na2CO3
难度: 中等查看答案及解析
-
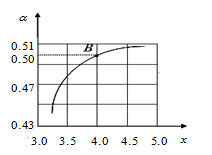
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )

A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 困难查看答案及解析
-
G20杭州峰会主题为“构建创新、活力、联动、包容的世界经济”,杭州为此次峰会大量引进了“钒电池”新能源公交车,“钒电池”的原理是利用钒的不同价态之间的转化,其充电原理可表示为2H+ + V2++ VO2+ = 2V3++ H2O,则下列说法不正确的是
A.阴极反应可表示为2H++VO2++e-=V3++H2O
B.阳极反应可表示为V2+-e-=V3+
C.放电过程种负极反应可表示为V3++2OH--e-=VO2++H2O
D.电解液体积为1L,pH=1,C(H+)=0.1mol/L;Ph=2;C(H+)=0.01mol/L;消耗氢离子的量为0.09mol;根据:2H++VO2++e-=V3++H2O关系:生成V3+的物质的量浓度为0.045mol/L
难度: 困难查看答案及解析
-
一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g)
PCl3(g)+Cl2(g),下列说法正确的是
编号
温度(℃)
起始/mol
平衡/mol
达到平衡
所需时间/s
PCl5(g)
PCl3(g)
Cl2(g)
Ⅰ
320
0.40
0.10
0.10
t1
Ⅱ
320
0.80
t2
Ⅲ
410
0.40
0.15
0.15
t3
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol•L-1•s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
难度: 困难查看答案及解析
-
将浓盐酸滴入KMnO4溶液,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入NaBiO3,溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。据此判断下列说法正确的是
A.滴加盐酸时,HCl是还原剂,Cl2是还原产物
B.已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性
C.若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.4NA
D.此实验条件下,物质的氧化性:KMnO4 > NaBiO3 > Cl2
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH
)·c(OH-)变大
难度: 中等查看答案及解析