-
在自然界中有很多循环过程,其中部分无机物循环过程如下图,则下列说法不正确的是( )
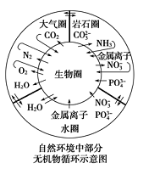
A.金属离子和硝酸根离子进入生物圈可能形成环境污染
B.碳元素在自然界中的循环主要是通过CO2的生成和消耗来实现的
C.自然界中不存在硫及其化合物的循环,因为在示意图中没能体现
D.雷雨天氮气和氧气的反应属于自然固氮的一种方式
难度: 简单查看答案及解析
-
“84”消毒液有效成分为 NaClO, 已知酸的电离平衡常数
,下列说法正确的是( )
A.“84”消毒液可以与福尔马林溶液混合使用
B.NaClO的稳定性和漂白性都比HClO强
C.工业上在特定条件下电解饱和食盐水制得NaClO,原理为:NaCl + H2O = NaClO +H2↑
D.NaClO溶液在空气中发生离子反应为:
难度: 中等查看答案及解析
-
下列有关物质的叙述正确的是( )
A.沼气和天然气气都是可再生的能源
B.盐酸和醋酸既是化合物又是酸
C.冰和干冰即是纯净物又是化合物
D.豆浆、牛奶和油脂都属于胶体
难度: 简单查看答案及解析
-
可用于焙烧的装置有以下几种,其中能用于SiO2和NaOH反应的装置为( )
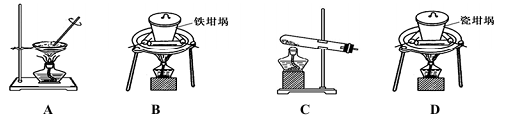
难度: 简单查看答案及解析
-
1mol过氧化钠与2mol碳酸氢钾固体混合后,在密闭容器中加热至250℃充分反应,排出气体物质后冷却,残留的固体物质和排出的气体分别是( )
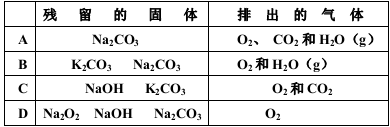
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数。下列说法正确的是( )
A.在含有NA 个CH3COO-的醋酸溶液中,H+数目略大于NA
B.常温下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.5NA
C.16.9g BaO2固体中阴、阳离子总数为0.3NA
D.含有1 mol Fe(OH)3的氢氧化铁胶体中含有胶粒数为NA
难度: 困难查看答案及解析
-
下列分子或离子在指定的分散系中一定能大量共存的一组是( )
A.常温下水电离出的c(H+)·c(OH-)=1×10-20的溶液:Na+、Cl-、S2-、SO32-
B.空气:C2H2、CO2、SO2、NO
C.含Al3+的无色溶液:Na+、SO42-、K+、ClO-、HCO3-
D.高锰酸钾溶液:H+、Na+、SO42-、NO3-
难度: 困难查看答案及解析
-
下列中学常见实验的现象或表述正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.用食醋检验牙膏中的摩擦剂碳酸钙:CaCO+2H+===Ca2++H2O+CO2↑
B.明矾溶于水产生Al(OH) 3胶体:Al3++3H2O===Al(OH)3↓+3H+
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O===Cl-+SO42-+2H+
D.Ca(HCO3) 2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
难度: 中等查看答案及解析
-
已知:
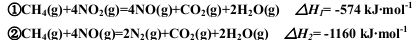
则CH4催化还原NOX的相关说法正确的是( )
A.由①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1)的△H大于△H1
B.等物质的量的甲烷分别发生①②反应至完全,转移的电子数不同
C.若用0.2 mol CH4发生上述反应还原足量的NO2至N2,放出的热量为173.4 kJ
D.若用标准状况下4.48 LCH4还原足量的NO2至N2,整个过程中转移的电子的物质的量为16 mol
难度: 困难查看答案及解析
-
甲乙两池均是电化学装置,按下图连接。乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
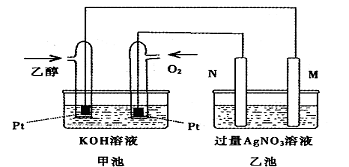
A.M电极的材料是石墨
B.若乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气为224mL
C.在此过程中,甲池中OH-向通乙醇的一极移动
D.在此过程中,乙池溶液中电子从M电极向N电极移动
难度: 中等查看答案及解析
-
下列溶液中相应关系正确的是( )
A.0.2 mol·L-1CH3COONa溶液和0.1 mol·L-1HCl溶液等体积混合后:
c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl -)
C.0.1 mol·L-1NaHCO3 溶液中: c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D.含SO42-、NH4+、H+、OH-的溶液中可能存在:c(H+)>c(SO42-)>c(NH4+)>c(OH-)
难度: 困难查看答案及解析
-
下面有关化学反应速率和限度的图像和实验结论表达均正确的是( )
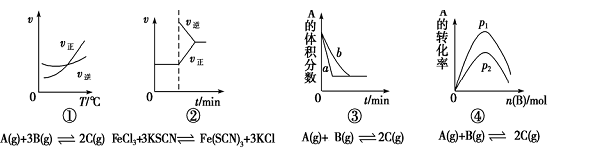
A.图①是其他条件一定时反应速率随温度变化的图像,图像表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移
B.图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
C.图③可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响
D.图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
难度: 困难查看答案及解析
-
一种新药物结构如图所示,下列有关说法正确的是( )
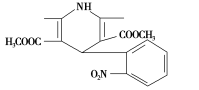
A.该化合物的分子式为C17H17N2O6
B.该化合物的分子中含有三种不同的官能团
C.该化合物的不饱和度为10
D.该化合物能发生水解反应、聚合反应、取代反应、消去反应
难度: 中等查看答案及解析
-
镍有电镀和化学镀两种方法,化学镀反应原理:
.下列说法错误的是
A.电镀镍时,Ni为阴极,镀件为阳极
B.电镀和化学镀原理都是利用氧化还原反应
C.化学镀无需通电,对镀件的导电性无特殊要求
D.化学镀中
中P化合价为+1,有强还原性
难度: 中等查看答案及解析
-
根据Al(OH)3 的Ksp = 1.3×10-33、 Mg(OH) 2的Ksp =5.6×10-12 ,等物质的量浓度AlCl3、MgCl2
混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
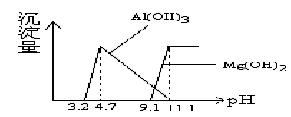
下列有关说法正确的是
A.Al(OH) 3和Mg(OH)2在水溶液中的电离过程完全相同
B.若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化
C.当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4])
D.物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似
难度: 困难查看答案及解析
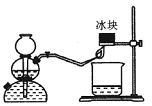
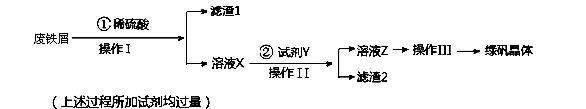
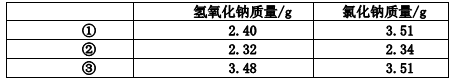
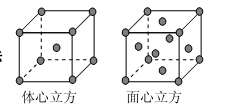

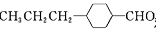 和________________(写结构简式)生成。
和________________(写结构简式)生成。