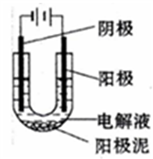
-
下列说法正确的是
A. 22.4LO2中一定含有6.02×1023个氧原子
B. 将80gNaOH固体溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L
C. 18gH2O在标准状况下的体积是22.4L
D. 在标况下,20mLNH3与60mLO2所含的分子个数比为1:3
难度: 中等查看答案及解析
-
目前有四个实验方案,可行的是
A. 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤
B. 分离汽油和煤油 ,可用萃取的方法
C. 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法
D. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
难度: 中等查看答案及解析
-
下列离子反应方程式,书写正确的是
A. 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑
B. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-=Cu(OH)2+SO42-
氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O
C. 硝酸银与氯化:AgNO3+Cl-═AgCl↓+NO3-
D. 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑
难度: 中等查看答案及解析
-
关于有机物的性质,下列说法不正确的是
A. CH4气体能与Cl2在光照条件下发生取代反应生成CCl4
B. CH2=CH2能使酸性高锰酸钾溶液褪色是因为发生了氧化反应
C. 通常情况下,苯是无色气体,能在催化剂条件下与Br2发生单取代反应
D. 乙醇和乙酯发生酯化反应生成乙酸乙酯是可逆反应
难度: 中等查看答案及解析
-
带有充满电解质KCl的饱和溶液盐桥的锌铜原电池工作时,下列叙述不正确的是
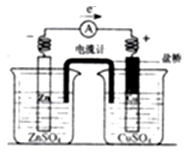
A. 用还原性较强的物质做为负极,负极向外提供电子:用氧化性较强的物质作为正极,正极从外电路得到电子
B. 盐桥中的K+会移向ZnSO4溶液,Cl-移向CuSO4溶液,使两个半电池保持中性
C. 盐桥的引入,解决了Zn直接与CuSO4溶液反应降低原电池工作效率的问题
D. 放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路
难度: 困难查看答案及解析
-
对已经达到化学平衡的反应2X(g)+Y(g)
2Z(g), △H<0
A. 减小压强时,正、逆反应速率都减小,平衡向正反应方向移动
B. 降低温度时,正、逆反应速率都减小,平衡向逆反应方向移动
C. 恒容时,充入稀有气体,Y的转化率变大
D. 此反应为熵减反应,△S<0
难度: 中等查看答案及解析
-
MOH是强碱溶液与等体积、等浓度的HA弱酸溶液混合后,下列叙述不正确的是
A. 弱酸的电离常数越小,其所产生的盐水解的程度越大
B. 溶液中发生的水解反应是A-+H2O
HA+OH-
C. 有关离子浓度大小关系是c(M+)>c(A+)>c(OH-)>c(H+)
D. 该溶液是酸性
难度: 困难查看答案及解析