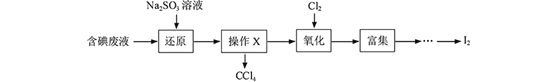
-
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4 溶于100ml水中
②将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A. ①② B. ②③ C. ①③ D. ①②③
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 非金属氧化物都是酸性氧化物 B. 金属氧化物都是碱性氧化物
C. 氧气与臭氧属于同素异形体 D. 氧化物都可以直接和水反应
难度: 中等查看答案及解析
-
氯化铁溶液与氢氧化铁胶体具有的共同性质是
A. 分散质颗粒直径都在l~100nm之间 B. 都能产生丁达尔效应
C. 加入浓氢氧化钠溶液都产生红褐色沉淀 D. 颜色都呈红褐色
难度: 简单查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子
Cl-
SO42-
H+
M
浓度 /(mol·L-1)
2
1
2
1
A. Na+ B. Al3+ C. NO3- D. Mg2+
难度: 中等查看答案及解析
-
化学实验中的很多气体是用盐酸来制取的,这就导致了这些制取的气体中往往含有HCl杂质,要除去HCl杂质而得到纯净的目标气体,可用如图所示装置。如果广口瓶中盛装的是饱和NaHCO3溶液,则可以用于下列哪种气体的除杂装置是
A. H2 B. Cl2 C. SO2 D. CO2
难度: 中等查看答案及解析
-
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A. a B. ab C. bcd D. abcd
难度: 中等查看答案及解析
-
下列实验基本操作中,正确的是
A. 倾倒液体
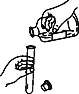 B. 过滤
B. 过滤 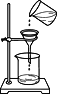
C. 加热液体
 D. 熄灭酒精灯
D. 熄灭酒精灯
难度: 简单查看答案及解析
-
下列实验操作中正确的是
A. 蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
B. 蒸馏时,应使温度计插入蒸馏烧瓶中的液体中
C. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 简单查看答案及解析
-
在同温同压下,a L气体X2和b L气体Y2恰好完全反应生成c L气体Z,若2a=6b=3c,则Z的化学式为
A. XY2 B. X3Y C. X2Y D. XY3
难度: 中等查看答案及解析
-
工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制城法”生产纯碱和化肥NH4Cl.工艺流程如图所示。下列有关说法不正确的是
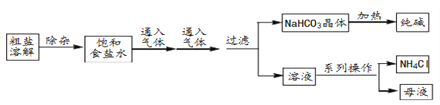
A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 粗盐可采用除杂和重结晶等过程提纯
C. 流程图中的系列操作中用到的玻璃仪器可能有玻璃棒、烧杯、漏斗、坩埚等
D. 该流程中得到的晶体用到了溶解度的差异性
难度: 中等查看答案及解析
-
下列实验目的可以实现或操作正确的是
A. 用托盘天平称取3.23 g NaCl固体
B. 用10 mL 量筒量取 7.50 mL 稀盐酸
C. 蒸馏时冷凝聚管中冷却水流向是上口进下口出
D. 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌
难度: 简单查看答案及解析
-
已知Na2SO4 和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的3/5倍,下列叙述中正确的是
A. 溶液中一定有1molNa2SO4和3molNaCl
B. SO42-是Na+所带电荷数的3/5倍
C. SO42- 与Cl-的物质的量之和等于Na+的物质的量
D. Na2SO4 和NaCl的物质的量浓度比为1:3
难度: 中等查看答案及解析
-
设NA 表示阿伏加德罗常数的值,下列说法不正确的是
A. 含有0.1NA个CO32-的Na2CO3固体的质量为10.6g
B. 100mL 0.1mol·L-1的稀硫酸中含有SO42-个数为0.1NA
C. 标准状况下,11.2LCCl4含有的分子数为0.5NA
D. 56克铁与足量稀盐酸反应,共失去2NA个电子
难度: 中等查看答案及解析
-
对下列实验过程的评价,正确的是
A. 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
B. 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀生成,证明含Cl-
C. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸正盐
D. 某溶液中先滴加少量BaCl2溶液,生成的白色沉淀不溶于盐酸,该溶液不一定含有SO
难度: 困难查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸试剂的物质的量浓度为18.4 mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200.0 mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0 mL
D.2.7 gAl与足量的该硫酸反应可得到标准状况下的H2 3.36 L
难度: 中等查看答案及解析