-
下列指定反应的离子方程式正确的是( )
A. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH-=2Al(OH)3↓ + 3BaSO4↓
B. (NH4) 2 Fe(SO4)2溶液与过量NaOH溶液反应: Fe2++2OH-═Fe(OH)2↓
C. 澄清石灰水中加少量NaHCO3: Ca2+ + 2 OH- + 2HCO3-═CaCO3↓+2H2O+CO32-
D. 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
难度: 中等查看答案及解析
-
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为短周期元素中原子半径最小的元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
A. B与A只能组成BA3化合物 B. E的氧化物对应水化物一定有强的氧化性
C. A、B、C三元素不可能形成离子化合物 D. 第三周期中D原子的原子半径最大
难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A. HF的电子式: H+[:
:]- B. HClO的结构式:H—O—Cl
C. S2﹣的结构示意图:
D. CH4分子的球棍模型:

难度: 中等查看答案及解析
-
分类是科学研究的重要方法,下列物质分类不正确的是( )
A. 化合物:干冰,冰水混合物,烧碱 B. 同素异形体:活性炭,C60,金刚石
C. 非电解质:乙醇,四氯化碳,氯气 D. 混合物:漂白粉,纯净矿泉水,盐酸,
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol Na2O2中含有的阴离子数为2NA
B. 标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA
C. 常温常压下,8g O3含有4 NA个电子
D. 常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA
难度: 中等查看答案及解析
-
下列各组离子中,一定能够大量共存的是( )
A. Na+、Al3+、Cl-、CO
B. Fe2+、H+、SO
、NO
C. K+、Fe3+、NO
、SCN- D. Mg2+、NH
、Cl-、SO
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 分子晶体中,共价键键能越大,分子的熔、沸点越高
B. pH=4的CH3COOH和NH4Cl溶液中,水的电离程度相同
C. 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
难度: 中等查看答案及解析
-
分子式为C4H8O2并能与氢氧化钠溶液反应的有机物有(不含立体异构)( )
A. 4种 B. 5种 C. 6种 D. 7种
难度: 困难查看答案及解析
-
某有机物的结构如图所示,这种有机物不可能具有的性质是
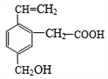
①可以与氢气发生加成反应;②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应
A. ①④ B. 只有⑥ C. 只有⑤ D. ④⑥
难度: 困难查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂 B. 还原剂与氧化剂的物质的量之比为2 : 1
C. 若生成0.2 mol HNO3,则转移0.2 mol电子 D. NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
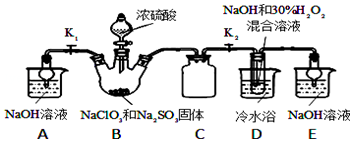
下列关于甲、乙、丙、丁四种仪器装置的有关用法, 其中不合理的是( )
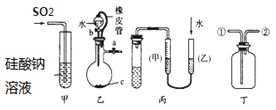
A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
难度: 中等查看答案及解析
-
常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如下图所示,列有关叙述正确的是( )
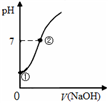
A. ①点所示溶液中只存在HClO的电离平衡
B. ①到②水的电离程度逐渐减小
C. I-能在②点所示溶液中存在
D. ②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
难度: 困难查看答案及解析
-
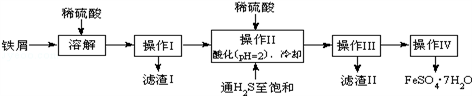
利用食盐水制取ClO2的工业流程如右图所示,
装置①中的反应:NaCl+3H2O
NaClO3+3H2↑,
装置②中的反应: 2NaClO3+4HCl
2ClO2+ Cl2↑+2NaCl+2H2O.
下列关于该流程说法不正确的是( )
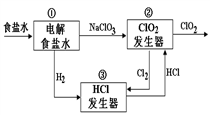
A. 该流程中Cl2、NaCl都可以循环利用
B. 装置①中H2是阴极产物
C. 装置②发生的反应中,Cl2是氧化产物,NaCl是还原产物
D. 为了使H2完全转化为HCl,需要向装置③中补充Cl2
难度: 困难查看答案及解析
-
下图是某校实验小组设计的一套原电池装置,下列有关描述 不正确的是( )
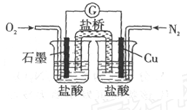
A. 石墨的电极反应:
B. 此装置能将化学能转变为电能
C. 电子由
电极经导线流向石墨电极
D. 电池总反应:
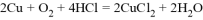
难度: 中等查看答案及解析