-
进行化学实验必须注意安全,下列操作不正确的是( )
A.做CO还原CuO的实验时,尾气用点燃的方法除去
B.实验室制备并用排水法收集氧气,实验结束时应先撤导管再熄灭酒精灯
C.金属钠、钾起火,可用水、泡沫灭火器等灭火
D.给试管中的液体加热时先预热并不时移动试管或加入碎瓷片,以免爆沸伤人难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.含大量Fe2+溶液中:K+、Cl-、NO3-、Na+
C.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
D.在酸性溶液中:Ba2+、Na+、SO42-、Cl-难度: 中等查看答案及解析
-
下列说法正确的是( )
A.胶体粒子的直径很小可以透过滤纸,因此可以用过滤的方法分离胶体和溶液
B.布朗运动不是胶体特有的性质
C.直径介于1-100nm之间的微粒称为胶体
D.有的胶体带正电荷或者负电荷,在电压作用下可电泳难度: 中等查看答案及解析
-
下列是某学生总结的一些规律,其中正确的是( )
A.一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物
B.酸性氧化物都可以与碱反应,生成盐和水
C.酸根离子中不可能含有金属元素
D.氧化物只能做氧化剂,不能做还原剂难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是( )
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.用过氧化钠与水反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
C.用氨水检验氯化镁溶液中混有氯化铝杂质:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
D.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O难度: 中等查看答案及解析
-
下列实验设计能完成预期实验目的是( )
选项 实验目的 实验设计 A 配制10%的ZnSO4 将10g ZnSO4•7H2O溶解于90g水中 B 配制100ml,浓度约为1mol/L的氯化钠溶液 用托盘天平称量5.85g氯化钠固体,转移至烧杯,加入100ml蒸馏水,搅拌溶解 C 验证二氧化硫的漂白性 将二氧化硫气体通入品红溶液,溶液褪色 D 取出分液漏斗中所需的上层液体 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收器,上层液体继续从分液漏斗下端管口放出
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
关于0.1mol/LNa2CO3溶液的叙述错误的是( )
A.0.5L该溶液中钠离子的物质的量浓度为0.05mol/L
B.1L该溶液中含有Na2CO3的质量为10.6g
C.从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.01mol/L
D.取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L难度: 中等查看答案及解析
-
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( )

A.该硫酸的物质的量浓度为18.4 mol•L-1
B.配制500mL 3.68 mol•L-1的稀硫酸,需取该硫酸100.0 mL
C.该硫酸与等体积的水混合,所得溶液的质量分数大于49%
D.该硫酸50mL与足量的铜充分反应,可得到标准状况下SO2 20.6 L难度: 中等查看答案及解析
-
在H2O2溶液中加入KI和H2SO4的混合溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;②H2O2+I2=2HIO;③H2O2+2HIO=I2+O2↑+2H2O.下列说法正确的是( )
A.H2O2在上述3个反应中均做氧化剂
B.H2O2氧化性强于HIO,还原性弱于I2
C.上述过程中每生成1mol氧气,消耗1mol双氧水
D.在反应后的溶液中加入淀粉,溶液呈现蓝色难度: 中等查看答案及解析
-
已知NA代表阿伏加德罗常数,下列说法正确的是( )
A.224mL氧气和氮气的混合气体的分子数为0.01NA
B.0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA
C.在0.2L 0.5mol/L AlCl3溶液中Al3+数目是Cl-数目的
D.5.6g铁粉在2.24L(标准状态)氯气中充分燃烧,失去的电子数为0.3NA难度: 中等查看答案及解析
-
氧化铁和氧化铜混合物mg,加3mol•L-1盐酸溶液100mL,恰好完全溶解,若mg的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为( )
A.(m-1.6)g
B.(m-2.4)g
C.(m-3.2)g
D.无法确定难度: 中等查看答案及解析
-
前几年俄罗斯科学家宣布用核反应得到了113号和115号两种新元素,质量数分别是284和288.下列关于这两种元素原子的说法正确的是( )
A.质子数相等
B.中子数相等
C.电子数相等
D.中子数和核外电子数之差相等难度: 中等查看答案及解析
-
下列说法正确的是( )
A.按分散剂种类可将分散系分为溶液、胶体和浊液
B.漂白粉、钢、氯水、Fe(OH)3胶体均为混合物
C.CO2、SO3、NO2和水反应均能生成相应的酸,都属于酸性氧化物
D.KNO3溶液、铜、熔融的NaCl均能导电,都属于电解质难度: 中等查看答案及解析
-
实验室中以下物质的贮存方法不正确的是( )
A.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.含NA个Na+的Na2O溶于1L水中,Na+的物质的量浓度为1mol•L-1
C.在标准状况下,2.8g N2和2.24LCO所含电子数均为1.4NA
D.2.24L SO2与O2混合气体中所含氧原子数为0.2NA难度: 中等查看答案及解析
-
在下列各组离子中能大量共存的是( )
A.K+、ClO-、SO42-、H+
B.K+、H+、NO3-、Fe2+
C.Na+、CO32-、Cl-、Ca2+
D.Na+、Cl-、SO42-、H+难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.用稀氢氧化钠吸收氯气:2OH-+Cl2=Cl-+ClO-+H2O
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++Cl2↑+H2O
C.向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO2↑+H2O
D.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=[Al(OH)4]-难度: 中等查看答案及解析
-
下列各项操作中发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2 ④向石灰水中通入过量CO2 ⑤向硅酸钠溶液中逐滴加入过量的盐酸.
A.①②④
B.②③⑤
C.②④
D.①③⑤难度: 中等查看答案及解析
-
实验室欲用碳酸钠固体配制500mL、0.10mol•L-1的Na2CO3溶液,下列叙述正确的是( )
A.实验用到的仪器有:托盘天平、烧杯、500mL容量瓶、玻璃棒
B.将称量好的固体放入500mL容量瓶中溶解
C.定容时若俯视刻度,则所得溶液浓度偏高
D.定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线难度: 中等查看答案及解析
-
把0.6mol铜粉投入含0.8mol硝酸和0.2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( )
A.0.2 mol
B.0.3 mol
C.0.4 mol
D.0.5mol难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
被提纯的物质 除杂试剂 分离方法 A 溴化钠溶液(NaI) 氯水、CCl4 萃取、分液 B 氯化铵溶液(FeCl3) 氢氧化钠溶液 过滤 C 二氧化氮(NO) 氧气 通入过量O2 D 碳酸氢钠溶液(碳酸钠) 二氧化碳 向溶液中通入过量CO2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是( )
A.离子半径:A2->C->B2+
B.C元素的最高正价一定为+7价
C.对应气态氢化物的稳定性A>C
D.还原性:A2-<C-难度: 中等查看答案及解析
-
下列实验过程中产生的现象与对应的图形正确的是( )
A.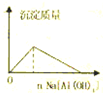
盐酸中加入Na[Al(OH)4]溶液
B.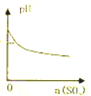
SO2通入溴水中
C.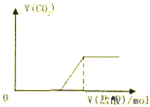
向Na2CO3溶液中逐滴滴加HCl
D.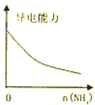
氨气通入醋酸溶液难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.4g铝与足量氢氧化钠反应转移的电子数为0.3NA
B.1 mol 乙酸分子中共价键总数为8NA
C.标准状况下,11.2 L苯所含原子数为6NA
D.160g胆矾溶于水形成1L溶液,溶液的物质的量浓度为1 mol/L难度: 中等查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法不正确的是( )
A.两元素形成的化合物中原子个数比可能为1:1
B.X与Y的简单离子可能具有相同电子层结构
C.X的原子半径一定大于Y的原子半径
D.X2Y可能是离子化合物,也可能是共价化合物难度: 中等查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关.下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是( )
A.①③
B.③④
C.①②
D.①③④难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用FeCl3溶液腐蚀铜板制印刷电路板:Fe3++2Cu=Fe2++2Cu2+
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:+CO2+2H2O=Al(OH)3↓+HCO3-
D.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O难度: 中等查看答案及解析
-
由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出.将气体通过足量的NaOH溶液,气体体积减少一部分.将上述混合物在空气中加热,有气体放出,下列判断正确的是( )(注:2Na2O2+2H2O=4NaOH+O2↑)
A.混合物中一定不含有Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中难度: 中等查看答案及解析
-
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述错误的是( )

A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.b-c时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量:Al(OH)3一定小于BaSO4
D.d-e时溶液中离子的物质的量:Ba2+可能等于AlO2-难度: 中等查看答案及解析