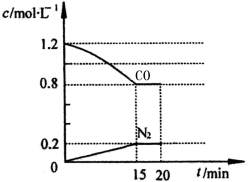
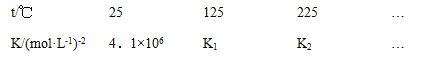-
金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比混合:c(Na+)+ c(H+)=c(OH-)+c( HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 中等查看答案及解析
-
下列各组物质,前者是混合物,后者是纯净物的是
A.淀粉与氯化氢 B.钢与浓硫酸
C.纯碱与汽油 D.胆矾与液氯
难度: 简单查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=(17V+22400)/(22.4+22.4V) B.ω=17c/(1000ρ)
C.ω=17V/(17V+22400) D.c=1000Vρ/(17V+22400)
难度: 困难查看答案及解析
-
下列过程一定释放出能量的是:
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
难度: 简单查看答案及解析
-
一定条件下,在密闭容器里进行如下可逆反应:S2Cl2(橙黄色液体)+Cl2(气)
2SCl2(鲜红色液体)△H=-61.16kJ·mol-1。下列说法正确的是
A.单位时间里生成n mol S2Cl2的同时也生成n mol SCl2
B.达到平衡时,若升高温度,压强不变,氯气转化率增大
C.达到平衡时,单位时间里消耗 n mol S2Cl2的同时也生成n molCl2
D.加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
难度: 中等查看答案及解析
-
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
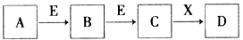
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
难度: 中等查看答案及解析
-
根据下列实验现象得出的结论不正确的是
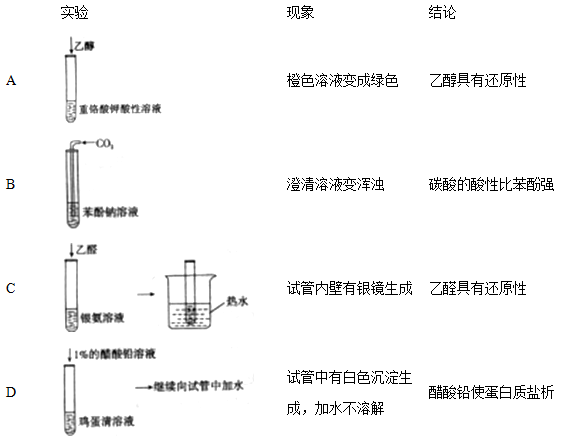
难度: 中等查看答案及解析
-
一定温度下,下列叙述是可逆反应A(g)+3B(g)
2C(g)在定容密闭容器中达到平衡的标志的是:( )
①C的生成速率与C的分解速率相等;
②单位时间内amol A生成,同时生成3amolB;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化
A.②⑤ B.①③④⑤ C.②⑥⑦⑧ D.⑤⑥⑧
难度: 中等查看答案及解析
-
常温下,相同物质的量浓度的下列物质的溶液,按PH减小的顺序排列的为
A.NaHSO4 CH3COONa NH4Cl NaNO3
B.NaNO3 CH3COONa NaHSO4 NH4Cl
C.NaNO3 CH3COONa NH4Cl NaHSO4
D.CH3COONa NaNO3 NH4Cl NaHSO4
难度: 中等查看答案及解析
-
下列说法中不正确的有
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②光照氯水有气泡逸出,该气体是Cl2;
③燃煤时加入适量石灰石,可减少废气中SO2的量;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。
⑥氯气易液化,液氯可以保存在钢瓶中;
⑦常温下浓硫酸可以用铝制容器盛放;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
A.2个 B.3个 C.4个 D.5个
难度: 中等查看答案及解析
-
一种充电电池放电时的电极反应为H2 + 2OH- - 2e- = 2H2O ;NiO(OH) + H2O + e- = Ni(OH)2 + OH-当为电池充电时,与外电源正极连接的电极上发生的反应是
A.H2O的还原 B.NiO(OH)的还原 C.H2的氧化 D.Ni(OH)2的氧化
难度: 简单查看答案及解析
-
有A、B、C、D四种非金属元素:A、B元素在反应中各结合一个电子形成稳定的结构,且B-的还原性小于A-的还原性;氢化物稳定性HD<HA;原子序数C<D,且C、D的稳定结构的核外电子数相等。则这四种元素的非金属性由强到弱的排列顺序是
A.ABCD B.BACD C.ABDC D.BADC
难度: 中等查看答案及解析
-
要将
转化为
应可选用的试剂和操作的是
①加入足量的NaOH共热后,再通入足量的CO2
②溶解,加热后通足量的CO2
③与稀H2SO4共热后加足量的 NaOH
④与稀H2SO4共热后加足量的NaHCO3
A.①② B.②③ C.①④ D.②④
难度: 中等查看答案及解析
-
下列表示化学过程的化学式书写正确的是:
A.亚硫酸钠溶液显碱性:SO32-+2 H2O
H2SO3 +2 OH-
B.氯化银投入水中后建立平衡:AgCl (s)
Ag+ (aq) + Cl-(aq)
C.甲烷的燃烧热为890.3kJ·mol-1,表示甲烷燃烧热的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6 kJ·mol-1
难度: 中等查看答案及解析
-
香柠檬油是从香柠檬树的果皮中提炼的橘子味的香油,33%的女用香水用到了这种原料。香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如右图。下列说法正确的是
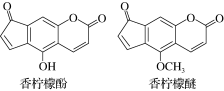
A.香柠檬醚的分子式为C13H6O4
B.香柠檬酚可与甲酸反应转化成香柠檬醚
C.1 mol香柠檬酚最多可与2 mol Br2发生反应
D.1 mol香柠檬酚最多可以与3 mol NaOH溶液反应
难度: 中等查看答案及解析
-
某烷烃的一种同分异构体只能生成一种一氯代物,则该烃的分子式不可能的是
A.C2H6 B.C4H10 C.C5H12 D.C8H18
难度: 中等查看答案及解析
-
下列描述,其因果关系成立的是
A. 因为NH3的水溶液可以导电,所以NH3是电解质
B. 因为O2可以与CO反应生成CO2,所以可以用O2除去CO2中的杂质CO
C. 因为液态HCl不导电,所以HCl是非电解质
D. 因为氢氧化铁胶体具有吸附性,所以常用于净水
难度: 中等查看答案及解析
-
2002年12月26日,俄罗斯特种部队使用强力麻醉剂芬太奴(Fentanyl)和氟烷(Halothane)。下列有关氟烷(CHClBr—CF3)说法正确的是:
A.该氟烷易溶于水,也易溶于有机溶剂
B.该氟烷扩散到空气中能破坏臭氧层
C.该氟烷密度比水小
D.与该氟烷互为同分异构体的氟烷(不含本身)有三种
难度: 简单查看答案及解析
-
下列反应中是离子反应,又是氧化还原反应的是
A.Fe + CuSO4 = Cu + FeSO4 B.2Na + Cl2
2 NaCl
C.NaCl + AgNO3 = AgCl↓+ NaNO3 D.2KClO3
2KCl + 3O2↑
难度: 简单查看答案及解析
-
下列离子方程式中,只能表示一个化学反应的是
①CO32-+2H+===CO2↑+H2O
②Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③Ag++Cl-===AgCl↓
④Fe+Cu2+===Fe2++Cu
⑤Cl2+H2O===H++Cl-+HClO
A.①③ B.②④ C.②⑤ D.只有⑤
难度: 中等查看答案及解析
-
已知:Fe2O3(s) +
C(s) =
CO2(g) + 2 Fe(s) ΔH=+234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔH=-393.5 kJ·mol-1
则2 Fe(s)+
O2(g) = Fe2O3(s) 的ΔH 是:
A.-169.4kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-824.4 kJ·mol-1
难度: 中等查看答案及解析
-
下列叙述中,错误的是( )
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.在纯水中加入少量硫酸铵,可抑制水的电离
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中 c(OH-)增大
D.纯水的pH随温度的升高而减小
难度: 简单查看答案及解析
-
1999年曾报导合成和分离了含高能量的正离子N
的化合物N5AsF6,下列叙述错误的是
A. N
共有34个核外电子
B. N
中氮-氮原子间以共用电子对结合
C. 化合物N5AsF6中As化合价为+1
D. 化合物N5AsF6中F化合价为-1
难度: 简单查看答案及解析
-
将足量HCl通入下述各溶液中,所含离子还能大量共存的是
A.K+、SO32-、Cl-、NO3-
B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42-
D.Na+、Ca2+、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
对于反应C(s)+H2O(g)
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为K=
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小
D.增加C(s)的量,平衡正向移动
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是( )
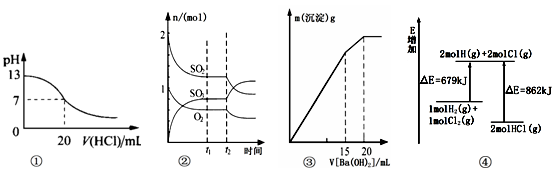
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g) + O2(g)
2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+C12(g)== 2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol
难度: 极难查看答案及解析
-
常温下0.1mol·L-1 亚硫酸溶液中H2SO3、HSO3—、SO32— 三者中所占物质的量分数(α)随pH 变化的关系如图所示。下列表述 正确的是
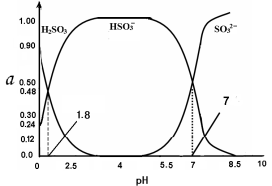
A.H2SO3
2H+ + SO32— K=10—5.2
B.在0.1mol·L H2SO3 溶液中,存在:c2(H+)= c(H+)·c(HSO3—) + 2c(H+)·c(SO32—) + Kw
C.在pH=2.5 溶液中: c(H2SO3)>c(HSO3—)>c(H+) >c(OH—)
D.向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3—)和c(SO32—)均减小
难度: 困难查看答案及解析
-
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性.根据这一特点科学家发明了电动势(E)法测水泥初凝时间,此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag.下列有关说法不正确的是( )
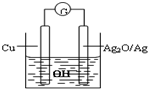
A.工业上制备普通水泥的主要原料是黏土和石灰石
B.测量原理装置图中,Ag2O/Ag极发生氧化反应
C.负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O
D.在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化
难度: 中等查看答案及解析
-
X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少l。下列说法正确的是( )
A. 三种元素的氢化物中只有极性键没有非极性键
B. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C. 三种元素的气态最简单氢化物中Z的氢化物最稳定
D. 原子半径由大到小的顺序为Z>Y>X
难度: 中等查看答案及解析