-
下列溶液与20mL 1mol·L-1 NaNO3溶液中NO3-物质的量浓度相等的是
A. 10mL 0.5mol·L-1 Cu(NO3)2溶液 B. 5mL 0.8mol·L-1 Al(NO3)3溶液
C. 10mL 1mol·L-1 Mg(NO3)2溶液 D. 10mL 2mol·L-1 AgNO3溶液
难度: 困难查看答案及解析
-
据《本草纲目》记载: “生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。 ”这里的“铜青”是指
A. CuO B. Cu2O C. CuSO4 D. Cu2(OH)2CO3
难度: 简单查看答案及解析
-
下列工作原理不涉及化学反应的是
A.火药使用
B.粮食酿酒
C.转轮排字
D.铁的冶炼
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于溶液和胶体的叙述正确的是
A. 溶液呈电中性,而胶体是带电的,因而胶体可以产生电泳现象
B. 胶体是胶状物体,可以用肉眼区分, 也可以用光照鉴别出来
C. 三角洲的形成、明矾净水及土壤保肥等均与胶体的性质有关
D. 纳米碳单质的直径在 1nm-100nm 之间,因此其属于胶体
难度: 中等查看答案及解析
-
2016 年,神舟十一号飞行乘组在天宫二号空间实验室工作生活 30 天, 创中国航天员记录,其中新材料铝锂合金功不可没。下列关于合金的认识不正确的是
A. 铝锂合金的优点是密度较小、强度较大
B. 含金属元素的离子,不一定都是阳离子
C. 铝锂合金的性质与各成分金属的性质完全相同
D. 改变原料的配比,可以制得性能不同的铝锂合金
难度: 中等查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影 3 区域的是
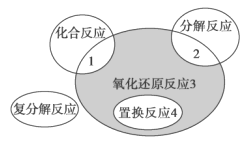
A. Cl2+2NaI==2NaCl+I2 B. CH4+2O2
CO2+2H2O
C. 4Fe(OH)2+O2+2H2O=4Fe(OH)3 D. 2H2O2
2H2O+O2↑
难度: 中等查看答案及解析
-
设 NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 物质的量浓度为 0.5 mol·L-1 的 MgCl2溶液中,含有 Cl-个数为 NA
B. 标准状况下, 22.4 L H2O 含有的分子数为 NA
C. 常温常压下, 1molCO2的质量等于 NA个 CO2 分子的质量之和
D. 56g 金属铁完全反应时失去的电子数为一定为 2NA
难度: 中等查看答案及解析
-
同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
难度: 困难查看答案及解析
-
15gA物质和10.5gB物质恰好完全反应,生成7.2gC物质,1.8gD物质和0.3molE物质,则E物质的摩尔质量是
A. 111 B. 55g/mol C. 111g/mol D. 55
难度: 中等查看答案及解析
-
若用
表示构成不同物质的原子,它们相互组合形成下列四种物质,其中表示混合物的是
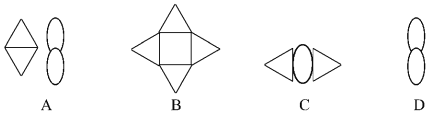
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
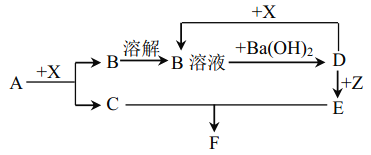
纳米级四氧化三铁是应用最为广泛的软磁性材料之一。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
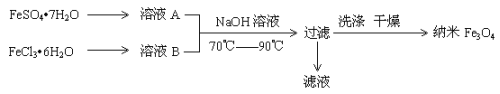
下列说法不正确的是
A.保存溶液A时,应加入少量铁粉
B.其制备反应类型不属于氧化还原反应
C.取滤液进行焰色反应,火焰为黄色
D.FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为2∶1
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 铜跟硝酸银溶液反应: Cu+Ag+===Cu2++Ag
B. 碳酸钙与盐酸反应: CO32-+2H+===CO2↑+H2O
C. 硫酸与氢氧化钡溶液反应: H++ SO42-+Ba2++OH-===BaSO4↓+H2O
D. Ba(OH)2与 CuSO4溶液反应: Cu2++ SO42-+Ba2++2OH-===BaSO4↓+Cu(OH)2↓
难度: 中等查看答案及解析
-
在 Al2(SO4)3、 K2SO4 和明矾的混合溶液中,如果 c(SO42﹣)等于 0.2mol/L, c(Al3+)等于0.1mol/L,则原混合溶液中 K+的物质的量浓度为
A. 0.2 mol/L B. 0.25 mol/L C. 0.1 mol/L D. 0.225 mol/L
难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A. Ba2+、 HCO3-、 OH—、 K+ B. Fe2+、 H +、 MnO4—、 SO42-
C. Fe3+、 Na+、 SO42-、 SCN— D. H+、 SO42-、 Cl—、 K+
难度: 中等查看答案及解析
-
微波是一种高频电磁振荡, “微波炉”就是利用高频电磁振荡使食品中分子也产生振荡而发热。现代医学上使用微波手术刀进行外科手术,其好处主要是使开刀处的血液迅速凝固而减少失血,关于其作用原理的说法正确的是
A. 微波电流迅速中和血液胶粒所带的电荷而凝聚
B. 微波使局部血液受热而使血液胶体凝聚
C. 微波电流通过金属手术刀时产生的高温使血液凝固
D. 以上说法都正确
难度: 简单查看答案及解析
-
向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
A. 1.14g B. 1.6g C. 2.82g D. 4.36g
难度: 中等查看答案及解析