-
下列各溶液中微粒的物质的量浓度关系表述正确的是
A.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A-)+c(Cl-)
B.在25 ℃ 100 mL NH4Cl溶液中:c(Cl-)=c(NH)+c(NH3·H2O)
C.0.1 mol·L-1的(NH4)2SO4溶液中:c(SO)>c(NH)>c(H+)>c(OH-)
D.0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO)+c(H2CO3)+2c(CO)
难度: 困难查看答案及解析
-
下列说法可以证明H2(g)+I2(g)
2HI(g)已达平衡状态的是
①单位时间内生成n mol H2的同时,生成n mol HI ②一个H—H 键断裂的同时有两个H—I键断裂 ③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI) ⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1 ⑥温度和体积一定时,各物质浓度不再变化 ⑦温度和体积一定时,容器内压强不再变化 ⑧条件一定,混合气体的平均相对分子质量不再变化 ⑨温度和体积一定时,混合气体颜色不再变化 ⑩温度和压强一定时,混合气体的密度不再变化
A.①②③④ B.②⑥⑨⑩ C.②⑥⑨ D.③⑤⑥⑦⑧
难度: 中等查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+O2(g)===SO2(g)+H2O(g) ΔH1; 2H2S(g)+SO2(g)===S2(g)+2H2O(g) ΔH2
H2S(g)+O2(g)===S(g)+H2O(g) ΔH3; 2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为
A.ΔH4=(ΔH1+ΔH2-3ΔH3) B.ΔH4=(3ΔH3-ΔH1-ΔH2)
C.ΔH4=(ΔH1+ΔH2-3ΔH3) D.ΔH4=(ΔH1-ΔH2-3ΔH3)
难度: 中等查看答案及解析
-
在以下的分子或离子的立体构型不是三角锥形的是
A.NF3 B.CH
C.SO3 D.H3O+
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
C.第一电离能可能Y小于X
D.气态氢化物的稳定性:HmY小于HmX
难度: 中等查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是
A.CO2 H2S B.C2H4 CH4
C.C60 C2H4 D.NH3 HCl
难度: 中等查看答案及解析
-
下列实验事实解释不合理的是
A.乙醇的沸点高于乙醛是因为乙醇分子间存在氢键,而乙醛分子间只有范德华力
B.单质碘易溶于CCl4而微溶于水,是因为I2和CCl4都是非极性分子而水是极性分子
C.NH3与CH4的空间构型不同是因为NH3中存在孤电子对而CH4中只有成键电子对
D.水分子比硫化氢稳定是因为水分子存在氢键
难度: 中等查看答案及解析
-
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2→2HCl+2COCl2.下列说法不正确的有
A.使用前可用硝酸银稀溶液检验氯仿是否变质
B.COCl2分子中中心C原子采用sp2杂化
C.COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D.CHCl3分子的空间构型为平面四边形
难度: 中等查看答案及解析
-
制取较纯净的一氯乙烷最好采用的方法是
A.乙烷和氯气反应 B.乙烯和氯气反应
C.乙烯和氯化氢反应 D.乙烷通入浓盐酸
难度: 中等查看答案及解析
-
只用一种试剂就能将甲苯、环己烯、四氯化碳、碘化钾溶液区分开来,该试剂可以是
A.溴化钾溶液 B.溴水 C.高锰酸钾溶液 D.硝酸银溶液
难度: 简单查看答案及解析
-
下列变化中,由取代反应引起的是
A.乙烯通入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色
B.在一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成
C.在一定条件下,苯与氢气反应生成环己烷
D.在催化剂作用下,乙烯与水反应生成乙醇
难度: 中等查看答案及解析
-
某烃含碳、氢原子物质的量之比为1:2,该烃对氮气的相对密度为2,该烃可使溴水褪色,该烃的二氯代物有四种同分异构体,该烃为
A.CH3CH2CH2CH3 B.CH2=CH—CH3
C.CH2=CH—CH2—CH3 D.CH2=C(CH3)2
难度: 中等查看答案及解析
-
某有机物的结构简式如右图所示,关于它的叙述不正确的是
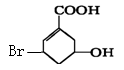
A.该有机物的分子式为C7H9O3Br
B.该有机物可使溴水褪色
C.该有机物可发生加成反应、消去反应、取代反应等
D.1mol该有机物与NaOH溶液反应时只能消耗1molNaOH
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如右图所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能)。下列有关叙述正确的是

A.催化剂能改变该反应的焓变
B.催化剂能降低该反应的活化能
C.该反应为放热反应
D.E1越大,表明该反应越容易发生
难度: 中等查看答案及解析
-
下列说法错误的是
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.煤炭燃烧前经过脱硫处理可减少酸雨的产生
C.燃料电池是一种高效、友好的发电装置,可将化学能完全转化为电能
D.太阳能的利用,一般是将太阳辐射能先转化为热能、电能或化学能,再加以利用
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A.钢铁在潮湿的空气中比在干燥空气中更容易生锈
B.用加热蒸干AlCl3溶液的方法不能制得无水AlCl3
C.蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者
D.已知N2(g)+3H2(g)
2NH3(g),工业上合成氨常在高压下进行
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.用铜为电极电解饱和食盐水:2Cl-+2H2O
Cl2↑+H2↑+2OH-
B.金属铝的冶炼:2AlCl3(熔融)
2Al+3Cl2↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- =Cu2+
D.碱性氢氧燃料电池的正极反应为:O2+4e-+2H2O=4OH-
难度: 中等查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂一KNO3的U型管)构成—个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极;②正极反应为:Ag++e-=Ag;
③实验过程中取出盐桥,原电池仍继续工作;④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②④ C.②③ D.③④
难度: 简单查看答案及解析
-
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
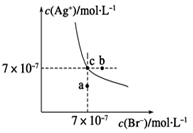
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)平衡常数K≈816
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol–1,则氢气的燃烧热为241.8kJ·mol–1
B.已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=–57.4kJ·mol–1,则含20.0g溶质的NaOH稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ
D.已知:2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
难度: 中等查看答案及解析
-
向密闭容器中充入一定量的N2和H2,发生反应N2(g)+3H2(g)
2NH3(g) △H<0,达到平衡后,要使正反应速率增大,且平衡向正反应方向移动,可采取的措施是
A.升温 B.及时分离出氨气
C.加入催化剂 D.增大容器内压强
难度: 简单查看答案及解析
-
在一定温度下的某容积可变的密闭容器中进行反应:C(s)+H2O(g)
CO(g)+H2(g)。下列说法或结论不成立的是
A.当体系的体积不再发生变化,该反应已建立平衡
B.达到平衡后向体系中充入少量He,平衡不移动
C.增大水蒸气的用量可以提高碳粉的转化率
D.若断裂1 molH-H键的同时断裂2molH-O键,则反应达到平衡
难度: 简单查看答案及解析
-
反应4X(g)+5Y(g)=4W(g)+6Q(g)在2L的密闭容器中进行,1分钟后,X 减少了0.12mol,则用Y来表示该反应在1分钟内的速率为
A.0.06mol/(L·min) B.0.075mol/(L·min)
C.0.09mol/(L·min) D.0.12mol/(L·min)
难度: 简单查看答案及解析
-
下列指定溶液中一定能大量共存的离子组是
A.pH=1的溶液中:NH、Na+、Fe3+、SO
B.含有大量AlO的溶液中:Na+、K+、HCO、NO
C.中性溶液中:K+、Fe3+、Cl-、SO
D.Na2S溶液中:SO、K+、Cu2+、Cl-
难度: 简单查看答案及解析
-
下列表述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH)>c(H+)=c(OH-)
B.中和等体积、等pH的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同
C.物质的量浓度相同的下列溶液:Na2CO3、KNO3、NH4Cl pH依次减小
D.将NH4Cl溶液蒸干制备NH4Cl固体
难度: 简单查看答案及解析