-
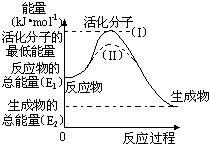
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+566.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热难度: 中等查看答案及解析
-
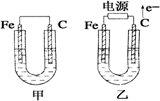
下列关于铜电极的叙述中不正确的是( )
A.在镀件上镀铜时可用金属铜作阳极
B.锌铜原电池中铜是正极
C.用电解法精炼粗铜时纯铜作阳极
D.用电解法精炼粗铜时粗铜作阳极难度: 中等查看答案及解析
-
2010年上海世博会的主题是“城市,让生活更美好”.下列有关说法错误的是( )
A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质
B.世博停车场安装催化光解设施,将汽车尾气中CO和NOx反应生成无毒气体
C.世博会期间用“玉米塑料”餐盒替代传统塑料餐盒,是为了防止带来白色污染
D.倡导人们使用乙醇汽油作为汽车燃料可真正实现二氧化碳零排放难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.属于放热和熵增加的反应,就更易自发进行
B.溶液在稀释过程中,溶液中的阴、阳离子浓度都减小
C.对某可逆反应而言,其平衡常数K值越大,反应物的转化率也越大
D.向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大难度: 中等查看答案及解析
-
下列对一些实验事实的理论解释正确的是( )
选项 实验事实 理论解释 A MgCl2溶液中加入浓氨水,出现白色沉淀 碱性:NH3•H2O>Mg(OH)2 B 用pH试纸测得CH3COONH4溶液的pH=7 CH3COONH4不能水解 C 氟化氢的沸点高于氯化氢 HF分子间存在氢键,而HCl分子间几乎不存在氢键 D 将SO2气体通入氯水中,氯水褪色 SO2具有漂白性
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列表达方式正确的是( )
A.Na+的电子排布图: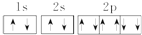
B.Na原子的简化电子排布式:[Na]3s1
C.钾原子的基态原子结构示意图为:
D.H2O电子式为:难度: 中等查看答案及解析
-
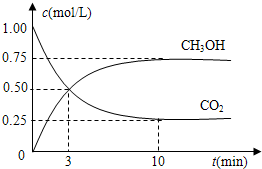
将2mol X和2mol Y充入2L密闭容器中发生反应:X(g)+3Y(g)⇌2Z(g)+a Q(g).2min达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.2 mol/L
C.Y的转化率为60%
D.反应速率v(Y)=0.3 mol/难度: 中等查看答案及解析
-
对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,醋酸溶液的pH变化程度大
D.加足量的锌充分反应后,两溶液中产生的氢气一样多难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂过滤后,再加入适量的盐酸,这种试剂是( )
A.NH3•H2O
B.NaOH
C.Na2CO3
D.MgCO3难度: 中等查看答案及解析
-
下列离子方程式不正确的是( )
A.碳酸氢钠溶液与足量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑
C.电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.亚硝酸钠水溶液显碱性:NO2-+H2O⇌HNO2+OH-难度: 中等查看答案及解析
-
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是( )
A.c(M+)>c(OH-)>c(A-)>c(H+)
B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+)
D.c(M+)>c(H+)>c(A-)>c(OH-)难度: 中等查看答案及解析
-
已知反应N2(g)+3H2(g)⇌2NH3(g);△H<0,向某体积恒定的密闭容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量(Y)随时间(t)变化的示意图,Y可以是( )
A.N2的转化率
B.混合气体的密度
C.密闭容器的压强
D.H2的体积分数难度: 中等查看答案及解析
-
下列有关说法错误的是( )
A.H2O、NH3、CH4分子的中心原子均为SP3杂化轨道类型
B.P、S、Cl元素的最高化合价依次升高
C.N、O、F电负性依次增大
D.Na、K、Rb第一电离能逐渐增大难度: 中等查看答案及解析
-
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节能诱发关节疼痛,其化学机理为:①HUr(尿酸)+H2O⇌Ur-(尿酸根离子)+H3O+;②Ur-(aq)+Na+ (aq)⇌NaUr(s).下列对反应②的叙述中正确的是( )
A.反应的△H<0
B.降低温度,平衡向逆反应方向移动
C.反应的△H>0
D.升高温度,平衡向正反应方向移动难度: 中等查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子
D.最外层都只有一个电子的X、Y原子难度: 中等查看答案及解析
-
已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10.在该温度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计).下列说法正确的是( )
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5 mol/L
C.沉淀生成后,溶液的pH为2
D.沉淀生成后,溶液中NO3-的浓度1.8×10-2 mol/L难度: 中等查看答案及解析