-
下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B.由C(石墨)=C(金刚石) ΔH=+1.9 kJ/mol,可知金刚石比石墨稳定
C.水力(水能)按不同的分类可看成可再生能源和一级能源
D.可表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
难度: 中等查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是
A.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
B.用托盘天平称得25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用10mL量筒量取7.13mL稀盐酸
难度: 简单查看答案及解析
-
可逆反应2NO2(g)
N2O4(g) △H<0,在密闭容器中进行并达到平衡,欲通过改变条件达到新平衡后使混合气体颜色加深,可采取的措施是
A.增大容器体积
B.保持温度压强不变,充入N2O4(g)
C.保持温度压强不变,充入NO2(g)
D.保持容器容积不变,升高温度
难度: 中等查看答案及解析
-
室温下,下列各组离子在给定条件的溶液中一定能大量共存的是
A.由水电离产生的c(H+)=10﹣12 mol•L一1的溶液中:K+、Na+、Fe2+、NO3﹣
B.pH=7的溶液中:Al3+、Cl-、HCO3﹣、SO42﹣
C.pH=13的溶液中:K+、Ba2+、Cl﹣、OH﹣
D.pH=13的溶液中: NH4+、Na+、HS﹣、Cl﹣
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.将AlCl3溶液蒸干得到的固体是AlCl3
B.锅炉水垢中的CaSO4可用饱和Na2CO3溶液浸泡,再用稀盐酸溶解除去
C.
加热纯水,KW变大、pH变小、呈酸性
D.在饱和BaSO4溶液中加入少量Na2SO4固体,溶液中c(Ba2+)增大
难度: 中等查看答案及解析
-
反应X(g)+Y(g)
2Z(g);
H<0,达到平衡时,下列说法正确的是
A.降低温度,能使Y的转化率增大
B.加入催化剂,能使Z的产率增大
C.增大c(X),X的转化率增大
D.缩小容器体积,平衡向右移动
难度: 简单查看答案及解析
-
为了除去ZnCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,使溶液的pH升高,过滤后再向溶液中加入适量盐酸,这种试剂不应该是
A.ZnO B.K2CO3 C.Zn(OH)2 D.ZnCO3
难度: 中等查看答案及解析
-
某化学反应的△H= -122 kJ·mol-1,∆S=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
难度: 中等查看答案及解析
-
25℃和1.01×105 Pa时,2N2O5(g) = 4NO2(g) + O2(g) △H=+56.76 kJ/mol,该反应能自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.是熵增大的反应
难度: 中等查看答案及解析
-
在25℃时,有100g饱和Ca(OH)2溶液,向其中加入纯CaO粉末a g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
A.溶液中c(Ca2+)将增大 B.溶液的pH将增大
C.溶液中Ca2+总数将减少 D.溶液中c(OH-)减小
难度: 中等查看答案及解析
-
常温下,取
浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1 B.0.017mol·L-1 C.0.05mol·L-1 D.0.50mol·L-1
难度: 中等查看答案及解析
-
下列说法正确的是
A.室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.相同温度下,将足量氯化银固体分别加入:① 蒸馏水、 ② 0.1 mol·L-1氯化镁溶液、③ 0.1 mol·L-1盐酸、④ 0.1 mol·L-1硝酸银溶液中,充分溶解后Ag+浓度:①> ③=④>②
C.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7
D.为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
难度: 中等查看答案及解析
-
对于0.1mol•L-1 Na2CO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(CO32―)+c(HCO3―)+ c(H2CO3)
C.c(Na+)+c(H+)=2c(CO32―)+ 2c(HCO3―)+ c(OH―)
D.加入少量NaOH固体,c(CO32―)与c(Na+)均增大
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.平衡移动,K值一定变化 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.K 值不变,平衡可能移动
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:aX(g)+bY(g)
cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是
A.平衡向逆反应方向移动 B.a+b<c+d
C.Z的体积分数增加 D.X的转化率下降
难度: 中等查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:
X(g)+m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 中等查看答案及解析
-
可逆反应aA(s)+bB(g)
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是

A.P1>P2,a+b=c+d
B.Pl<P2,b=c+d
C.T1>T2,正反应放热
D. Tl<T2,正反应吸热
难度: 困难查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O==O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g) +O2(g) +6N2(g)的△H为
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
难度: 困难查看答案及解析
-
下图是425℃时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
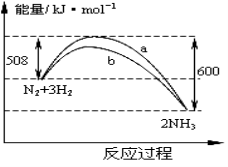
A.该反应的热化学方程式为:N2+3H2
2NH3 △H=-92kJ·mol-1
B.一定条件下N2+3H2
2NH3达到平衡时,3v正(H2) =2v逆(NH3)
C.加入催化剂,该反应的反应热发生改变
D.温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1
难度: 中等查看答案及解析
-
反应SO2(g) + NO2(g)
NO(g) + SO3(g)在一定条件下建立平衡,保持温度和容器体积不变再加入一定量的O2,下列说法正确的是
A.平衡左移,容器内压强不一定增大
B.平衡右移,达到平衡时容器内压强一定增大
C.平衡右移,SO2的转化率提高
D.平衡不一定移动,容器内压强一定增大
难度: 中等查看答案及解析
-
25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是

A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B.在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+),
C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
难度: 困难查看答案及解析
-
在pH相同、体积相等的盐酸A和醋酸溶液B中,分别加入等质量的锌,若充分反应后,
有一种溶液中锌有剩余,则正确的判断是
①反应所需时间B>A ②开始时反应速度A>B ③参加反应的锌的质量B>A
④整个反应阶段平均速率B>A ⑤盐酸中锌有剩余 ⑥乙酸溶液中锌有剩余
⑦盐酸中产生氢气多 ⑧乙酸溶液中产生氢气多
A.③④⑤⑧ B.①③⑥⑦ C.①②③⑥ D.②③④⑤
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入10mL水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mlpH=11的NaOH溶液,混合溶液pH=7
难度: 中等查看答案及解析
-
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+ H2O(g)
CO2 (g)+ H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(CO)/mol
n(H2O)/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是
A.反应在t1min内的平均速率为
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
难度: 困难查看答案及解析
-
恒温恒容条件下,可逆反应
达到平衡,下列叙述不是反应达到平衡的标志
① C的生成速率与C的分解速率相等
② 单位时间生成amolA,同时生成3amolB
③ A、B、C的浓度均不再变化
④ A、B、C的物质的量之和不再变化
⑤ 混合气体的总压强不再变化
⑥ 混合气体的密度不再变化
⑦ 单位时间内消耗a molA,同时生成3a molB
⑧ A、B、C的物质的量之比为1︰3︰2
A.⑤⑥⑧ B.③④⑦ C.①③⑥ D.②⑥⑧
难度: 中等查看答案及解析
-
在恒容密闭容器中加入一定量的X并发生反应:2X(g)
Y(g),在温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是

A.该反应进行到N点放出的热量大于进行到W点放出的热量
B.T2下,在0 ~t1时间内,c(Y)=
mol·L-1·min-1
C.W点的正反应速率V正大于N点的逆反应速率V逆
D.W点时再加入一定量X,再达平衡后X的转化率减小
难度: 中等查看答案及解析